|
Traitement des
eaux...................................................Analyse de l'eau de
BOUSFER
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
Titre du graphique
y = 1,2x - 1,8
-1
0
1
2
3
4
5
6
0
0,108
0,209
0,431
0,548
absorbence
concentration
c=f(abs)
Linéaire (c=f(abs) )
![]()
![]()
![]()
![]()
![]()
INTRODUCTION
......................................................................................................................1
&&&&&&.53INTRODUCTION 2
TITRE ALCALIMETRIQUE (TA, TAC) 9
MESURE DE LA CONDUCTIVITE ELECTRIQUE 16
MESURE DU PH 22
Electrode combinée 24
DOSAGE DES CHLORURES 28
DOAGE DES NITRITE « NO 2-» 34
METHODE DU REACTIF ZAMBELLI 34
C3 = 0,46 mg/l. 38
DOSAGE DES NITRATE (NO3-) 44
«METHODE DE BRUCINE » 44
DOSOGE DES PHOSPHATES « PO4-3 »
50
« METHODE DU REACTIFS ULFOMOLY
BDIQUE » 50
OXYDABILITE AU KMNO4 « METHODE A
CHAUD » 57
60
Pour vérifier le titre d'une solution de
permanganate de potassium, on propose différentes substances de base,
par exemple H2C2O4. 2H2O, Na2C2O4, As2O6, le fer métallique, etc. Les
substances qui conviennent le mieux sont Na2C2O4 et H2C2O4. 2H2O. Elles doivent
être chimiquement pures et correspondre exactement à leur
formules. L'oxalate de sodium n'est pas hygroscopique ; il ne contient pas
d'eau de cristallisation et ne se modifie pas au cours de sa conservation.
L'acide oxalique est quelque peu plus difficile à épurer que
Na2C2O4, il n'est pas hygroscopique non plus. 60
DOSAGE DE L'OXYGENE DISSOUS METHODE DE
« WINKLER » 62
DOSAGE DE L'ANHYDRIDE CARBONIQUE 67
« MATIERE EN SUSPENSION »
«MES» 71
...................53INTRODUCTION
L'étude de l'eau a pour objet de déterminer ses
possibilités d'utilisation ; elle comporte une analyse
physico-chimique et un examen bactériologique.
L'analyse physico-chimique fait connaître les emplois
auxquels convient une eau données, besoins ménagers (eau de
cuisson ou de lavage...), besoins industriels (eau de
réfrigération ou de fabrication...), elle décèle
les eaux risquant d'exercer une action chimique sur les canalisations, elle
facilite la mise au point des traitements qui supprimeront les
inconvénients révélés .L'eau est un constituant
fondamental de notre environnement, c'est le seul composé qui peut se
trouver dans les trois états de la matière (solide, liquide, ou
gazeux) aux températures ordinaires.
À ORAN(en arabe Warhan), ville du nord-ouest de
l'Algérie, au sud de bou-sfer à 400 m de altitude entre le mont
de mudjardjo et cap blanc situe la source naturelle de BOU-SFER appelé
par la population TODORRO.
BOU SFER (Camp de), : Anciennement Aïn-Boucefar, le
village est créé en 1850, érigé en commune de plein
exercice en 1863 situé en face de la base marine de Mers el-Kebir.
Lors de l'indépendance de l'Algérie, le 2e REP se
voit donné pour mission de protéger la base marine. Il est
regroupé le 13 sept. 1962 dans un camp qui prend le nom de
« Camp Segrétain ».
L'implantation prévue est vierge de toute construction
sur l'emplacement de vignes, au fond d'une cuvette bordée au nord par
des dunes qui la sépare de la mer à proximité. Les
légionnaires se mettent à l'ouvrage et construisent d'abord camp
de toile, puis la nécessité de construire en dur les
bâtiments collectifs, se fait bien vite ressentire aux premières
pluies. .
- La nappe de Bousfer Ain-Turck:
Cette nappe est l'une des plus importantes de la région.
Elle est constituée par des grès et sables quaternaires, parfois
surmonté par les colluvions du Djebel Murdjadjo. L'épaisseur de
ces colluvions présente un maximum de 60 mètres au Sud de Bousfer
et diminue progressivement vers le nord pour disparaître
complètement. Au niveau de cette nappe, un certain nombre de fosses
septiques côtoie les puits d'exploitation. Les risques de pollution sont
donc à craindre. Les sources de pollution sont:
- Les eaux usées domestiques: Le village de Bousfer et le
village agricole débitent un volume assez important d'eaux usées
sans aucun traitement. Il faut également ajouter la présence de
dépôts d'ordures ménagères immédiatement au
Nord de Bousfer village. Par ailleurs, la région jouissant d'une
vocation agricole, de grandes quantités d'engrais chimiques et
organiques sont déversés sans discernement et participent, par
lessivage, à la pollution de la nappe.
Les communes de Ain-Turck,
Cap-Falcon, Bousseville, Trouville, Saint-Rock et Bousfer village utilisent
toujours les fosses septiques.
- Les cimetières: Le cimetière
de Sidi Bouameur, situé sur le piémont du Djebel Murdjadjo.
Constitue un danger de pollution non négligeable pour la population
comprise entre Saint- Rock et Bousfer village, si on considère que les
eaux infiltrées au niveau du piémont vont participer à
l'alimentation de la nappe en aval .C'est un grand cimetière qui
desserre tous les habitants de Bousfer, Ain-Turck, Cap-Falcon, Trouville,
Saint-Rock et le village agricole qui est situé sur les brèches
de pentes, ce qui pollue directement les eaux de la nappe.
- Les bains
maures : Les bains maures de Ain-Turck et de Bousfer village constituent
également une source grave de pollution (présence de
détergents en grande quantité). Les bains maures de Ain-Turck
déversent leurs eaux usées en mer tandis que le bain de Bousfer
est raccordé au réseau collectif d'assainissement.
TITRE HYDROMETRIQUE (T.
H)
Une eau est dite dure quand elle contient une forte proportion
d'ions calcium et magnésium; cela se traduit par une eau qui mousse
difficilement en présence de savon, d'autre façon c'est la teneur
de l'eau en sels de chaux et sels de magnésie qui détermine sa
dureté ou sa douceur, en langage courant la teneur en calcaire. Pour
mesurer la dureté (le titre hydrométrique) on va utiliser le
degré de dureté qui correspond à une concentration de
carbonate de calcium (CaCO3) en mg par Litre (mg/l) ou une
concentration de chaux (CaCO). 0 pour une eau d'une pureté absolue
théorique à 60 pour une eau impropre à l'usage
même industriel.
Une eau douce D.H. 5 à moyenne D.H. 15 peut être
utilisée pour l'arrosage et le bassinage des plantes. L'eau adoucie par
les sels n'est supportée par aucune plante, elle est juste bonne pour le
jardin.
Si l'on ne possède pas d'eau de pluie en quantité
suffisante, l'eau du robinet est en définitive la plus pratique. Mais
elle contient du chlore qui est relativement mal supporté par les
plantes. On a donc intérêt à récolter l'eau le soir,
la laisser reposer toute la nuit, le chlore se sera dégradé
pendant ce laps de temps.
La dureté de l'eau se situe idéalement entre
10°F et 20°F. Une valeur trop faible entraîne la corrosion, une
valeur trop élevée, ce qui est le plus fréquent,
entraîne l'entartrage si le pH est trop élevé. Il faudra
alors surveiller attentivement la valeur du pH.
Principe :
Les ions des éléments alcalino-terreux
présents dans l'eau forment un complexe du type chélate avec le
sel de l'acide éthylène-diamine-tétracétique.
La disparition des dernières traces
d'éléments libres à doser est décelée par le
virage de l'indicateur spécifique. En milieu convenablement
tamponné pour empêcher la participation du magnésium, la
méthode permet de doser la somme des ions du calcium et du
magnésium.
Réactifs :
Solution titrée de l'EDTA N/50 ;
Solution tampon ;
Indicateur noir d'ériochrome T.
Mode opératoire :
Prendre 100 ml d'eau à analyser à l'aide
d'une pipette de 100 ml et les transférés dans un erlenmeyer de
500 ml. La solution est chauffée à 60°C, et on ajoute 5 ml
de la solution tampon et quelque mg de l'indicateur. On titre alors avec la
solution titrée de l'EDTA jusqu'au virage du rouge violacé au
bleu.
Expression des résultats :
VEDTA = 29ml.
T.H = (V E.D.T.A * N
E.D.T.A) * 1000 /100
T.H = V * N * 10 (méq/l)
= 29* 0,02 * 10 = 5.8 méq..
ð
T.H = 5.8méq/l
Interprétation :
Sauf exception très particulière, la
dureté a un caractère naturel lié au lessivage des
terrains traversés et correspond à la teneur en calcium et en
magnésium. Il n'est pas facile de définir un niveau en ce qui
constitue une eau dure et une eau douce. Cependant, on peut considérer
qu'une eau ayant une teneur inférieure à 75 mg/l de CaCO3
ou à 30mg/l de Ca est une eau douce et qu'au dessus, il s'agit
d'une eau dure.
En fonction de considérations domestiques, l'O.M.S.
recommande pour l'eau destinée à la consommation humaine une
valeur limite de 500 mg/l exprimée en CaCO3.
Le directive des communautés européenne
indique comme concentration minimale requise 60 mg/l de calcium ou cations
équivalents pour les eaux livrées à la consommation
humaine et ayant subit un traitement d'adoucissement. La réglementation
française fixe pour la dureté totale une valeur limite de
50° français et indique que pour les eaux ayant subit un traitement
d'adoucissement, elle ne doit pas être inférieure à
50° français.
Réponses aux questions :
a/ La dureté en (°F) et
(mg/l) :
On a: 1°F = 1/5 méq/l = 0.2 meq =10
mg/l
donc : TH = 4.6 * 5 = 29°F
1°F ð 10mg/l
23°F ð TH = 290mg /litre de
CaCO3.
50 mg/l = 1meq ð TH = 5.8 * 50 =
290mg/l de CaCO3
Les inconvénients d'une dureté
élevée :
La dureté plus élevée engendre une
consommation élevée du savon, c'est pour cela on utilise des
agents ayant le pouvoir de ségestrie les ions de Ca 2+ et
Mg2+ lors de la fabrication.
Sous l'action de chaleur la libération du
CO2 s'accompagne de la précipitation de CaCO3 ce
qui pose un problème particulier aigu dans les cas des chaudières
industrielles a haute pression.
Une eau dure est riche en HCO3- peut
devenir sur saturée en CaCO3 s'il y a hausse PH donc cela
provoque l'incrustation des conduites.
Certaines industries ne peuvent tolérer les
inconvénients causés par la présence des ions Ca2+
et Mg2+ telles que la fabrication des textiles et la
fabrication des produits pharmaceutiques.
Pourquoi on a pas intérêt d'avoir une dureté
nulle :
Les eaux trop douces présentent également un
inconvénient outre leur goût fade, elles corrodent davantage les
métaux, il peut même arriver que des métaux ait
caractère toxique comme le cadmium ou le plomb est se libérer
- comme un intérêt industriel, l'eau dures riches en
carbonates et bicarbonates de calcium réduisent leur
corrosivité.
Donc on peut résumer les inconvénients d'une
dureté élevée dans ces 4 points
Ø La consommation de savon (perte de savon) ;
Ø L'entartrage des chaudières ;
Ø L'incrustation des conduites ;
Ø La perturbation des procédés
industriels.
Les L'intérêt à avoir une
dureté nulle au niveau des chaudières :
Sous l'action de la chaleur, la libération de
CO2 s'accompagne de la précipitation de CaCO3 ce
qui pose un problème particulièrement aigu dans le cas des
chaudières industrielles à haute pression. Donc on peut
citer :
Ø L'augmentation des mousses (qui explosent ou
éclatent en libérant des particules d'eaux).
Ø L'accroissement de la pression entraîne une
explosion des chaudières.
Ø L'eau douce dissolvent d'abords les anciens
dépôts de calcaires, es suite les métaux tel que le
« Zn, Pb » des tuyauteries, ainsi implique la contamination
de l'eau qui est nuisible pour la santé.
II existe deux sortes de
dureté :
La dureté totale ou hydrométrique
TH :
Elle pressente les somme des concentration de calcium et
magnésium en mg/l.
La dureté temporaire ou carbonatée
:
C'est la quantité de bicarbonates de calcium ou de
magnésium ou de fer pressente dans un litre d'eau. Ce genre de
dureté peut être éliminé par simple chauffage
Ca(HCO3)2 ð
CaCO3 + H2O + CO2ì
Mg(HCO3)2 ð
MgCO3 + H2O + CO2ì
La dureté permanente :
Elle est déterminée par la quantité
de sulfates, de chlorures, et de phosphates présentes dans un litre
d'eau.
La dureté calcique :
Correspond à la teneur globale en sel calcium.
La dureté
magnésienne :
Correspond a la teneur en sels de magnésium.
La somme des deux duretés (permanente et temporaire)
donne la dureté totale de l'eau ou ce qu'on appelle titre
hydrométrique.
TH = [Ca2+] + [Mg2+]
La relation qui existe entre la dureté
temporaire et la dureté permanente :
La dureté permanente =
dureté totale - titre alcalimétrique complet
La dureté permanente =
TH - TAC
La dureté temporaire = TH (total) = TAC si on a
seulement HCO3-
La dureté totale = TH [Ca2+] + TH
[Mg2+]
TITRE
ALCALIMETRIQUE (TA, TAC)
Définition :
Ces deux valeurs permettent de connaître les concentrations
en bicarbonates, carbonates et éventuellement en hydroxydes (bases
fortes) contenues dans l'eau, d'autre façon l'alcalinité d'une
eau correspond à la présence des bicarbonates, carbonates et
hydroxydes.
L'alcalinité se mesure par la neutralisation
d'un certain volume d'eau par une solution diluée d'un acide
minéral. Le point d'équivalence étant
déterminé par des indicateurs colorés
Indépendamment des difficultés qu'il
peut y avoir pour l'opérateur à apprécier le virage de
l'indicateur, l'emploi de la méthode volumétrie que doit
être évite en présence de substances telles que les acides
humiques, les phosphates, les tartrates, etc.... qui retardent le virage. La
méthode potentiomètre est recommandée dans le cas des eaux
troubles et colorées et en présence de matières en
suspension.
L'alcalinité se mesure à l'aide d'une solution
étalon d'acide fort en présence d'indicateurs colorés de
pH :
- La phénophtaléine pour le TA, virant du rouge
à l'incolore à un pH de 8,3.
- L'hélianthine pour le TAC, virant du jaune à
l'orangé à un pH de 4,3.
Le TA dose la totalité des hydroxydes et la moitié
des carbonates qui sont alors entièrement transformés en
bicarbonates à un pH de 8,3.
Le TAC correspond à la totalité des bicarbonates et
des carbonates.
Donc on peut dire que :
- Le titre alcalimétrique ou T.A mesure la teneur en
alcalis libres (OH-) et en carbonates (CO3).
- Le titre alcalimétrique complet ou T.A.C mesure la somme
des alcalis libres, des carbonates et des bicarbonates.
Domaine d'application :
C'est une méthode par la détermination
titrimétrie de l'alcalinité.
Elle est destinée à analyse de l'eau naturelle et
traitée de l'eau résiduaire et peut être directement
utilisée pour les eaux ayant une concentration d'alcalinité
jusqu'à 20 m mole/l pour les échantillons contenant des
concentrations supérieurs d'alcalinité, il convient de prendre un
portion d'essai plus faible pour l'analyse, la limite inférieure est de
0.4 m mole/l.
Les matières en suspension sous forme de carbonate peuvent
interférer avec l'analyse.
Cette interférence peut être réduite par
filtration avant le titrage.
Principe :
Ces mesures sont basées sur la neutralisation d'un
certain volume d'eau par un acide minéral, en présence d'un
indicateur coloré.
Réactifs :
Acide chlorhydrique ou acide sulfurique 0,02 N
Solution de phénophtaléine dans l'alcool à
0,5%.
Solution de méthylorange à 0,5%.
Mode opératoire :
Détermination du
T.A :
Prélever 50 ml d'eau à analyser dans un
erlenmeyer de 250 ml, ajouter 1 à 2 gouttes de
phénophtaléine. Une coloration rose doit alors
apparaître ; dans le contraire le T.A est nul, ce qui se produit en
général pour les eaux naturelles dont le PH<8,3. Verser
ensuite doucement l'acide dans la capsule à l'aide d'une burette, en
agitant constamment et ceci jusqu'à décoloration complète
de la solution (PH=8,3).
Soit V le nombre de millilitres d'acide versés V= 0ml.
Explication
En présence de phénophtaléine (PH = 8.3),
par dosage par une solution d'un acide fort H2SO4, on va
donc avoir :
OH- + H3O+ ð
2H2O
CO32- +
H3O+ ð HCO3- +
H2O
A ce niveau, on peut mesurer donc les ions OH- et les
ions CO3- qui correspond au titre alcalimétrique
(TA) mais lorsque le PH< 8.3, le titre alcalimétrique TA est nul.
Détermination du T.A.C :
Utiliser l'échantillon traité
précédemment ou le prélèvement primitif s'il n'y a
pas de coloration. Ajouter 2 gouttes de méthylorange et titrer de
nouveau avec le même acide jusqu'au virage du jaune au jaune
orangé (pH = 4,3).
Soit V' le nombre de millilitres
d'acide versés depuis le début du dosage.
Retrancher 0,5 ml, quantité d'acide nécessaire
pour le virage de l'indicateur, qui est un peu plus faible que le pH de
neutralisation exacte de l'hydrogénocarbonate.
Explication :
En présence de méthyle orange, on aura les
réactions suivantes :
OH- + H3O+ ð
2H2O
CO32- + H3O+
ð H20 + HCO3-
HCO3- + H3O+
ð H2O + H2CO3
Le virage du méthyle orange e produit dès que le PH
< 4.4, c'est-à-dire dès qu'il apparaît un excès
d'acide fort dans le milieu, on mesure donc la somme des ions OH-,
CO32- et des HCO3- ; cette
détermination correspond au TAC.
Ce tableau résume les valeurs des concentrations des
différents anions en fonction du TA et TAC.
|
Alcalinité
|
Hydroxyde
|
Carbonate
|
Bicarbonate
|
|
TA = 0
|
0
|
0
|
TAC
|
|
TA <TAC/2
|
0
|
2TA
|
TAC - 2TA
|
|
TA = TAC/2
|
0
|
2TA
|
0
|
|
TA >TAC/2
|
2TA - TAC
|
2 (TAC - TA)
|
0
|
|
TA = TAC
|
TA
|
0
|
0
|
Expression des résultats :
TA = (VH2SO4 *NH2SO4*1000) /
volume de la prise d'essai en méq / litre.
Le TA de notre eau est nul puisque la coloration rose n'a pas
apparu après l'ajout du phénophtaléine à notre
échantillon et on a aussi l'eau est potable. TA =
0
TAC = (V'H2SO4-0,5)*NH2SO4*
0.1 en méq/l.
TAC = (18.7 - 0,5)*0,02 * 0.1 = 0.0364méq/l
TAC = 0.0364méq/l
Réponses :
1/ TA et TAC en °F et en mg de CaCO3 par
litre d'eau :
On a :
1° F à 1/5 méq/l à10
mg/l.
TA = 0 méq/l = 0° F = 0 mg/l.
TAC = 0.0364 * 5 = 0,182 °F
CaCO3 ð Ca2+ +
CO3-
1eqgr à M/valence = 100/2 = 50 gr/l.
1meV à 50 mg/l
1°F ð 50/5 = 10 mg/l.
1°F ð 10 mg/l
0.182 °F ð 1.82 mg/l donc TAC = 1.82 mg
de CaCO3/litre d'eau.
Les relations existantes entre TA, TAC et TH
La dureté carbonatée correspond à la teneur
en hydrogène carbonate et carbonate de calicule et de magnésium,
elle est égale a TAC si le TH est supérieur au TAC, et au TH si
le TAC est supérieur au TH.
Le titre alcalimétrie TA qui correspond aux alcalis libres
et aux carbonates alcalins caustiques.
La dureté permanent ou non carbonaté correspond a
la dureté qui persiste après ébullition de l'eau, elle
représente la teneur en sulfate et chlorure de calcium et
magnésium, elle est égale a (TH - TAC).
MESURE DE LA CONDUCTIVITE ELECTRIQUE
Objet et domaine d'application :
L'objet de ce TP est de mesurer la conductivité
électrique de tous types d'eau.
La conductivité électrique peut être
utilisée pour contrôler la qualité :
1. Des eaux de surface
2. Des eaux dans la distribution de l'eau et les stations de
traitement
3. Des eaux résiduaires
Définition :
Conductance spécifique : conductivité
électrique ; Inverse de la résistance, mesurée
dans des conditions spécifiées entre les faces opposées
d'un cube unité (de dimensions déterminées) d'une solution
aqueuse.
Pour l'examen de la qualité de l'eau. Celle-ci est souvent
appelée « conductivité électrique » et
peut être utilisée comme mesurage de la concentration des
solutés ionisables présents dans l'échantillon.
Elle est exprimée en siemens par mètre.
Constante de la cellule de mesure : Grandeur
exprimée en mètres à la puissance moins un, donnée
par l'équation
= 1 / A
1. 1 S/m = 104 S cm = 103 mS cm.
2. Coefficient de température de conductivité
électrique peut être exprimé en Kelvin à la
puissance mois un ou en pourcentage par degré celsius.
Où :
l est la langueur, en mètres, d'un conducteur
électrique donné :
A est l'aire, en mètres carrés, de la section
transversale de ce conducteur électrique.
La constante de la cellule de mesurage résulte de la
géométrie de la cellule ; elle peut être
déterminée empiriquement.
Donc on peut dire que La conductivité électrique
« O » d'une eau est la conductance inverse
de la résistance « R » d'une
colonne d'eau comprise entre deux électrodes métalliques.
C'est donc l'inverse de la résistivité
« P » et elle s'exprime par la
relation :
La conductivité électrique est fonction d'un
certain nombre, de facteur comme la température, le PH en tout
préciser la quantité d'ion en solution, la conductivité
d'une solution n'est proportionnelle à la concentration en sels que
lorsque cette dernière reste faible.
- La conductivité d'une eau s'exprime
généralement en « U S /C
N »
- La relation entre la résistivité et la
conductivité est la suivante :
Principe :
La mesure est basée sur le principe du pont de
Wheatstone, en utilisant comme appareil de zéro un galvanomètre
ou une image cathodique.
Matériel spécial :
Conductimètre, électrode.
Mode opératoire :
Mettre l'appareil en marche, étalonner le avec
une solution de KCL de concentration connue, et donc de conductivité
connue.
Plonger l'électrode dans votre échantillon et lire
la conductivité relative à votre échantillon directement
sur l'appareil en (uS/cm) ou en (mS/cm).Rincer l'électrode après
chaque mesure, les lectures se font à une température constante
de 20°C ou à 25°C.
Résultats :
Conductivité =767uS/cm = 0.767mS/
cm.
Calcule de minéralisation à partir de la
conductivité :
Calcul de minéralisation a partir de la
conductivité thermique trouvée.
La minéralisation a 20°C en mg/l
Il existe une relation entre la teneur en sels dissous d'eau et
sa conductivité :
|
Conductivité uS/cm
|
Minéralisation mg/l
|
|
Conductivité< 50 uS/cm
|
1.365079. conductivité
|
|
Conductivité [50 à 166] uS/cm
|
0.947658. conductivité
|
|
Conductivité [166-333] uS/cm
|
0.769574. conductivité
|
|
Conductivité [333-833] uS/cm
|
0.715920. conductivité
|
|
Conductivité [833-10000] uS/cm
|
0.758544. conductivité
|
|
Conductivité > 10000 uS/cm
|
0.850432. conductivité
|
La table de calcul de la minéralisation nous permet de
calculer la minéralisation à partir de la conductivité.
D'après cette table, la conductivité est comprise
entre [333-833] uS/cm, donc la minéralisation à 20 °C en
mg/l est de 0.715920.
ð La minéralisation est :
M =0.715920*C= 0.715920* 767 = 549,11064mg/l
ð M = 549,11064mg/l
L'effet de la température sur la
conductivité :
La conductivité et aussi proportionnelle à la
concentration en minéraux dissous ionisées
La concentration est extrêmement à la
température, il est donc important de compte de toutes les
conductivités ç une température de
référence, habituellement à 25 °C.
Pour une solution typique, la règle générale
serait :
C25 = Ct ((45/t) + 20).
C25 : la conductivité à 25
°C ;
Ct : la conductivité à t
°C ;
Donc la conductivité augment beaucoup lorsque la
température s'accroire, ce phénomène s'explique par le
fait que la mobilité des ions augments à cause de la diminution
de la viscosité du milieu. Ce ci provoque bien que le transport de
courant soit solidaire du transport de courant est solidaire du transport de
matière.
Le tableau suivant montre l'influence de la température
sur la conductivité équivalente pour différents
électrolytes :
|
Electrolyte
|
Concentration
|
18 °C
|
100°C
|
210°C
|
|
NaCl
|
0.02N
|
103.2
|
361
|
721
|
|
AgNO3
|
0.02N
|
97
|
284
|
443
|
|
H2SO4
|
0.02N
|
358
|
472
|
461
|
Interprétation :
La mesure de la conductivité permet
d'évaluer rapidement mais très approximativement la
minéralisation globale de l'eau et d'en suivre l'évolution.
Dans le cas d'un contrôle de distribution d'eau potable,
l'intérêt de cette méthode ne réside pas dans une
seule mesure mais dans une série de détermination ou
d'enregistrement en continu qui permettront de déceler les variations de
composition pouvant signaler des arrivées d'eau susceptibles
d'être usées, dans les eaux de surface et les rejets d'eaux
usées, des modifications importantes de la conductivité peuvent
intervenir rapidement au cours de la journée. En France, environ 90% des
eaux superficielles ont une conductivité inférieure à
1000uS.cm-1 .En ce qui concerne les eaux destinées à
la consommation humaine .une enquête du Ministère de la
santé réalisée en France en 1981 a montrer qu'environ 2%
de la population reçoit une eau dont la conductivité
électrique est supérieure à 1000uS.cm-1 et que
près de 90% de la population reçoit une eau dont la
conductivité électrique est comprise entre 200 et
1000uS.cm-1.
Quelques indicateurs sur la relation existante entre
la minéralisation et la
conductivité :
Conductivité < 100uS.cm-1 :
minéralisation très faible ;
100uS.cm-1 < conductivité <
200uS.cm-1 : minéralisation
faible ;
200uS.cm-1 < conductivité <
333uS.cm-1 : minéralisation moyenne ;
333uS.cm-1 < conductivité <
666uS.cm-1 : minéralisation moyenne accentuée
;
666 uS.cm-1 < conductivité < 1000
uS.cm-1 : minéralisation importante ;
Conductivité <1000 uS.cm-1
: minéralisation élevée ;
Conclusion
La directive des communautés européennes relative
à la quantité des eaux destinées à la consommation
humaine indique pour la conductivité un niveau guide de 400
uS.cm-1 à la température de 20°C.
50 à 400 uS/cm
Qualité excellente
400 à 750uS/cm
Bonne qualité
750 à 1500uS/cm
Qualité médiocre mais eau
utilisable
> 1500 uS/cm
Minéralisation excessive
D'après ce tableau et les résultats obtenus, on
établit que notre échantillon (eau à analyser) est de
qualité médiocre mais c'est une eau utilisable qui possède
une conductivité qui varie de 833 à 10000uS/cm-1, donc
pour considérer cette eau comme une eau de consommation pour l'homme
elle doit avoir une conductivité inférieur à 400
uS.cm-1 ou on à une qualité excellente.
MESURE DU PH
Introduction :
Le potentiel Hydrogène (PH) est un coefficient qui
caractérise l'acidité ou la basicité d'une eau. Une eau
est acide si son pH est inférieur à 7, basique si son PH est
supérieur à 7. Une eau est dite neutre à PH 7. Le PH d'une
eau naturelle dépend de son origine et de la nature des terrains
traversés.
Un pH inférieur à 7 peut provoquer une corrosion
des tuyauteries métalliques. Supérieur à 8, il
entraîne une diminution de l'efficacité du processus de
désinfection au chlore et peut conduire à des dépôts
incrustants dans les circuits de distribution donc :
- Le PH est un nombre qui nous indique l'acidité d'une
solution.
- Le PH c'est le potentiel-hydrogène est le logarithme
décimale de la concentration des ions de H3O+.
PH = - Log [H3O+]
Quelque soit la pureté d'une eau elle est toujours
conductrice. Cette conductibilité est due à la dissociation
(très faible) de l'eau en ions hydrogène (H+) et
hydroxyde (OH-)
Dans n'importe quelle solution aqueuse sont toujours
présentes les trois espèces chimiques molécule d'eau
« H2O » ion hydronium
« H3O+ » et ion hydroxyde
« OH- ».
Dans l'eau pure il y `a autant d'ions hydronium que d'ions
hydroxyde OH-. Lorsqu'on dissout un soluté dans de l'eau
pure, après dissolution :
- Si [H3o+] = [OH-], la solution est
neutre.
- Si [H3o+] > [OH-], la
solution est acide
- Si [H3o+] < [OH-], la
solution est basique.
Les populations en ions hydroxyde et en ions hydronium ne sont
pas indépendantes, ces populations sont arisées par la
réaction réversible :
H3O+ + OH- ð
2H2O
Cette réaction se déplace vers la droite ou vers la
gauche, de façon qu'une fois la solution d'équilibre atteinte, au
bout d'un temps très court.
[H3O+]. [OH-] =
Ke
La constante « Ke » est
appelée « produit ionique de l'eau ». C'est un
nombre sans unité qui dépend de la température de la
solution aqueuse. Il faut tenir qu'à 25c°, Ke =
10-14(sauf précision contraire tout les solutions aqueuses
étudiées sont supposées être à 25 C°).
La détermination du PH de l'eau est une indication
relativement fiable, de sa tendant ce acide ou alcaline. Une valeur de PH
de moins de 7indi que une tendance à l'acidité alors qu une
valeur supérieure à 7indi que une tendant ce à
l'alcalinité.
La mesure du PH est une considération importante en ce qui
concerne la détermination de l'action corrosive de l'eau et
l'évaluation des pratiques de traitement d'eau au niveau des
procèdes industriels.
Si PH = 7 solution neutre.
- Si PH < 7 solution acide.
- Si PH > 7 solution basique.
Le PH est en relation étroite avec la concentration des
ions H+ présents dans l'eau ou les solutions. (Les ions H+
présents dans les eaux naturelles sont dus à des causes diverses
en particulier à l'ionisation de l'acide carbonique et de ses sels.)
.
L'électrode de verre est universellement employée
pour la mesure du pH des eaux.
Car elle ne modifie pas l'équilibre ou les concentrations
gazeuses et d'autre part, elle est insensible aux groupes
oxydoréductions.
L'objective :
Ce travail a pour objet la description de la mesure du PH des
eaux par la méthode potentiométrique au moyen de
l'électrode de verre.
Elle précise les caractéristiques essentielles
à exiger de l'appareillage en vue d'obtenir des résultats
comparables et d'autre part elle constitue une normalisation du mode d'emploie
de l'électrode de verre et des techniques à suivre pour obtenir
des résultats corrects.
La norme est applicable dans le cas de mesures effectuées
sur des eaux dont la température est comprise entre 0° C et
60°C.
Elle n'est pas applicable pour la détermination des
valeurs de PH supérieur à 11 unités avec les
électrodes de verre habituelles.
Principe :
La mesure de la différence de potentiel existant entre une
électrode de verre et une électrode de référence
(calomel-Cl saturé) plongeant dans une même solution, est une
fonction linéaire du pH de celle-ci. Selon la loi de NERSNST, le
potentiel de l'électrode est lié à l'activité des
ions H+.
E = E° + (2,3 RT/nF)*Log aH
E : Potentiel mesuré.
Eo : Constante
dépendant du choix de l'électrode de référence et
des solutions internes.
R : Constante des gaz (J/°C) ;
T : température absolue en °C
n : charge de l'ion ; F :
constante de Faraday = 96500 C
aH : activité de l'ion
dans l'échantillon (H+).
Matériel spécial :
· Electrode spécifique
· Electrode combinée
· PH - mètre
Réactifs :
-Solutions tampons :
PH = 4,7 et 10.
Mesures :
· Etalonnage de l'appareil à T = 20°C, par la
solution de pH = 4
Puis celle du
PH = 10 et enfin avec celle de pH = 7, en rinçant
après chaque étalonnage l'électrode.
· Faire les mesures de vos échantillons à T =
20°C en plongeant l'électrode dans votre échantillon et
laisser stabiliser pendant quelques secondes ; noter la valeur du pH de
votre échantillon
Résultat :
La valeur de notre échantillon est égale à :
PH = 6.734
1°) le pH d'une eau représente son acidité ou
son alcalinité étant donné le pouvoir tampon de l'eau, et
sauf dans le cas des rejets industriels particuliers, il est rare que le PH
soit une contre indication à la potabilité.
Le PH des eaux naturelles est lié à la teneur des
terrains traversés, il varie habituellement entre 7,2 et 7,6.
Les eaux qui ont un PH inférieur à 7,2 ou
supérieur à 7,6 sont considérées comme des eaux
distribuées où collectives.
Le PH de l'eau à analyser est de 6,755 donc l'eau
utilisée c'est une eau distribuée.
En pratique, les eaux ayant un PH inférieur à 6 ou
supérieur à 8 sont rares, le PH est caractère important
pour définir la nature de l'eau (agressive ou incrustante).
Une eau à un PH acide est un milieu corrosif surtout si
cette eau contient certains gaz dissous (O2, CO2).
Un pH élevé peut conduire à des
dépôts incrustant dans les circuits de distribution.
Généralement, le PH d'une eau potable est compris
entre 5,5 et 9.
La mesure de PH d'une eau destinée à la
consommation humaine où même industrielle doit s'effectuer sur
place de préférence par la méthode de
électrométrie.
C'est la seule méthode qui donne des résultats
exacts, car elle est indépendante de la couleur du milieu, de la
turbidité, des matières colloïdales et du potentiel
d'oxydoréduction.
· Lorsque l'eau est acide ð
[H3O+] > 10-7 moles/l d'où PH <
7.
· Lorsque l'eau est basique ð
[H3O+] < 10-7 moles/l ou bien PH >7.
Le PH de l'eau à analyser est de 6.734 ;
D'après les valeurs obtenues, on peut classer cette eau
comme étant une eau consommable, mais qui nécessite un
traitement.
Le PH d'eau potable est usuellement compris entre 7 et 8,5 ;
donc notre eau peut être consommée.
En ce qui concerne la
température :
La température augmente lors d'une augmentation du PH du
milieu.
Conclusion :
L'OMS préconise pour l'eau destinée à la
consommation humaine, un PH compris entre 6,5 et 8,5 ; la directive des
communautés européennes précise que l'eau ne doit pas
être agressive et indique comme niveau guide 6,5= pH = 8,5 ; avec
une valeur maximale admissible de 9,5 ; elle rappelle que les valeurs du
pH ne s'appliquent pas aux eaux conditionnées.
DOSAGE DES CHLORURES
Introduction :
L'eau contient toujours de chlorures, mais en proportion
très variable. En effet, les eaux prévenant des granitiques sont
pauvres en chlorures, alors que les eaux des régions
sédimentaires en contiennent d'avantage, d'ailleurs, la teneur en
chlorure augmente avec le degré de minéralisation d'une eau
(aussi de la conductivité).
Définition :
Les chlorures sont présents en grande quantité dans
l'eau de mer. Leur concentration dans l'eau de pluie est approximativement de
3mg/l.
F La teneur en chlorures d'une eau dépend
de l'origine de l) eau et de la nature du terrain qu'elle
traverse.
F Les chlorures participent à la
conductivité électrique des cours d'eau.
F Concentration supérieure à
200mg/l : eau laxatives et éventuellement dangereuses pour les
Patients atteints de maladies cardio-vasculaires ou
rénales, pollution possible (rejet industriel ou rejet d'eaux
usées).
F Niveau guide de la concentration en chlorures
des eaux destinées à la consommation humaine :
25mg/l.
F Concentration maximale admissible des
chlorures dans les eaux destinées à la consommation
humaine : 200mg/l. Seuil gustatif : à
partit de 200 mg/l environ.
F Les ions cl- participent dans la
formulation moléculaire de KCl , NaCl , et HCl .
F Les sels ont la propriété de
déposer sur les parois de la tuyauterie et provoquent un bouchage.
Il est important pour le laboratoire de connaître la
quantité de chlorure dans une eau distillée, afin
d'empêcher le bouchage des tuyauteries.
A/ METHODE DE MOHR :
Introduction :
L'eau contient toujours de chlorures, mais en proportion
très variable. Ainsi, les eaux provenant des régions granitiques
sont pauvres en chlorures, alors que les eaux de s régions
sédimentaires en contiennent d'avantage. D'ailleurs, la teneur en
chlorures augmente avec le degré de minéralisation d'une eau.
Certaines eaux souterraines sont très saumâtres. L'eau de mer
contient environ 20 000 mg/l d'ions chlorure et la salinité des
rivière qui s'y déversent peut être très
élevée au voisinage de l'embouchure.
Principe :
Les chlorures sont dosés en milieu neutre par
solution titrée de nitrate d'argent en présence de chromate de
potassium. La fin de la réaction est indiquée par l'apparition de
la teinte rouge caractéristique du chromate d'argent.
Réactifs :
Acide nitrique pur;
Carbonate de calcium pur;
Solution de chromate de potassium (10%);
Solution de nitrate d'argent (0,1N).
Mode opératoire :
On introduit dans un erlenmeyer 50 ml d'eau à analyser
préalablement filtrée, on ajoute 2 à 3 gouttes d'acide
nitrique, une pincée de carbonate de calcium 0,2 gr de carbonate de
calcium et 3 gouttes de chromate de potassium à 10%. On verse alors au
moyen d'une burette la solution de nitrate d'argent jusqu'à l'apparition
d'un précipité de teinte rougeâtre ; cette couleur doit
persister.
Soit V le nombre de millilitres de nitrates d'argent 0,1 N
utilisés pour le titrage.
Expression des résultats :
Teneur en Cl- = VAgNO3*N
AgNO3 * 1000*MC / V' (prise d'essai) l
Teneur en Cl- = (2.8* 0.1*1000*35.5)/100
= 2.8*0.1*35.5*10
Teneur en Cl- = 99.4mg/l
Teneur en NaCl = VAgNO3*NAgNO3
*1000*MNaCl / V'(prise d'essai)
Teneur en NaCl = (2.8 * 0.1* 1000 * 58,5)/100
= 2.8 * 0.1* 58,5*10
Teneur en NaCl = 163.8mg/l
Les réactions mises en jeu dans ce dosage sont :
Ag+NO3- + Cl- ð
AgCl î + NO3-
2(Ag+NO3-) +
2K+CrO42- ð
Ag2CrO4î +
2(K+NO3-)
L'utilisation de K2CrO4 à titrer
d'indicateur est basée sur la propriété de l'ion
CrO42- de donner avec ion Ag+ un
précipité rouge brique de Ag2CrO4 qui ne
commence toutes fois à se déposer qu'après que les ions
Cl- à doser ont été pratiquement tous
précipités sous forme de AgCl.
2 Ag NO3 + K2CrO42-
ð Ag2CrO4 + 2
KNO3
B/ Méthode de Charpentier Volhard
:
Principe :
Les chlorures d'un volume connu d'eau sont
précipités en présence d'acide nitrique par un
excès de nitrate d'argent titré. L'excès de nitrate
d'argent est déterminé par une solution titrée de
sulfocyanure d'ammonium en présence d'alun ferrique.
Réactifs :
Acide nitrique pur;
Solution de nitrate d'argent (0,1N);
Solution de sulfocyanure de potassium ou d'ammonium à 0.1
N;
Solution d'alun ferrique saturée et
décolorée par quelques gouttes d'acide nitrique.
Mode opératoire :
Introduire 50ml d'eau à analyser dans un erlenmeyer
de 250ml puis ajouter une quantité connue de nitrate d'argent N/10 en
excès.
Soit V(ml) de nitrate d'argent utilisées , ajouter alors
5ml d'acide nitrique concentré et 2 ml d'alun ferrique et titré
l'excès de nitrate d'argent par la solution de sulfocyanure d'ammonium
N/10 jusqu'à coloration rougeâtre persistante en agitant
après chaque addition . Soit v" (ml) le nombre de ml de sulfocyanure
versé.
Expression des résultats :
[Cl -]= (v - v") * NAgNO3* 1000 *
MCl / V'
[Cl -] = (4 -2.7) * 0,1 * 35,5
*10
[Cl - ] = 46.15mg Cl/l
d'eau
[NaCl] = (v - v") * NAgNO3* 1000 * MNaCl
/ V'
[NaCl] = (4-2.7) * 0,1 * 58,5 *10
[NaCl] = 76.05mg Cl/1 d'eau
Comparaison entre la méthode de
«Mohr» et la méthode de
«Volhard» :
Le plus souvent, lors de titrage argentrimétrique
à titre indicateur de solution de chromate de potassium K2 CrO4
(méthode de Mohr) ou d'alun feroammonaicaux NH4Fe
(SO4)2 méthode de volhard.
La méthode de Mohr de est basée sur le
titrage d'une solution de sel d'un halogène (par exemple de NaCl) par
une solution de AgNO3 en présence de l'indicateur
K2CrO4.
On termine le titrage au moment ou la coloration de la
suspension passe du jaune pâle (ce qui s'explique par la présence
dans la solution des ions CrO4 2-) en rouge brun. La
cause de changement de changement de coloration est le début du
dépôt du précipité rouge de AgCrO4 se
produit prés du point équivalent, c'est à dire au moment
ou pratiquement tout Cl- est précipité sous forme de
AgCl.
Par contre la méthode de Volhard est basée sur la
solution de feroammoniacaux. NH4Fe (SO4)2 ou
CNS-.
La méthode de Mohr est préférable que celle
de Volhard, ceci est due à la précision, et ceci permet de dire
que celle de Mohr détermine la qualité de l'eau
précisément, et si on s'appuis sur la teneur en chlorures dans
les eaux naturelles.
Commentaires :
Les teneurs en chlorure des eaux sont exactement
variées des témoins traversés.
Les termes en chlorures des eaux naturelles sont
susceptibles de subir des variations provoquées, le grand
inconvénient des chlorures est la saveur désagréable
qu'ils communiquent à l'eau surtout lorsqu'il s'agit de chlorure de
sodium (Na ). Ils sont aussi susceptibles d'amener une comesion dans les
conditions et les réservoirs, les risques augmentent à partir
de 150 mg/l. L'OMS recommande que la teneur en Cl- des eaux ne
dépasse pas 250 mg/l. La directrice des communautés
européennes implique comme teneur dans l'eau de la consommation humaine
à 25mg/l.
Les inconvénients liés à la
présence des ions chlorures :
Il n'y a pas de normes concernant les chlorures dans
l'eau potable. Cependant, si, la teneur est supérieure à 250
mg/l, elle affecte alors le goût de l'eau (surtout si les ions
Cl- sont accompagnés d'ions Na+).quant aux eaux
industrielles, leur teneur élevée en chlorures rend l'eau
corrosive (ces ions attaque les métaux par piqûre)
DOAGE
DES NITRITE « NO 2-»
METHODE DU REACTIF ZAMBELLI
Introduction :
Suivant l'origine eaux, la teneur en nitrites est assez variable.
La méthode du réactif de peut être appliquée pour
des eaux ayant des teneurs en ions No2- superi eues
à 50 ppb (mg/l) . Il sera nécessaire d'en tenir compte pour
l'interprétation des résultats et de prendre touts les
précaution utiles pour la pureté des réactifs et de la
propreté de la verrerie.
Sous l'action des phénomènes biologiques,
l'équilibre entre l'ammoniac, les nitrites et les nitrates peut
évoluer rapidement. Il convient de procéder au dosage des
nitrites le plus tôt possible après prélèvement en
le conservant à 4 °C.
Définition :
Les nitrites sont considérée comme polluant
très nuisible à la santé de l'être humain et au
animaux (le taux de NO2 devient nocif quand il dépasse 0.5
mg/l). Le taux doit être contrôle régulièrement, un
taux important survient en générale lorsque l'eau est sur
chargée en matières organique, et que les bactéries ne
sont pas suffisantes pour les transformer en nitrates. Cela arrive aussi
parfois lorsque vous rajoutez de nouvelles pierres vivantes.
Principe :
L'Acide sulfamilique en milieu chlorhydrique, en
présence d'ion ammonium et de phénol forme avec les ions un
complexe coloré en jaune dont l'intensité est proportionnelle
à la concentration en nitrites.
Réactifs :
Ammoniaque pure (d=0,928) ;
Réactif de Zambelli ;
HCl ;
Acide sulfamiliquePhénol ;
Chlorure cristallée ;
Eau distillée ;
Solution étalon mère de NO2-
à 0,23.
Mode opératoire :
On prélève 50 ml d'eau à analyser, on
ajoute 2 ml de réactif de Zambelli. On ajuste et on laisse reposer
10 min : on ajoute 2 ml d'ammoniaque, pure, on effectue la lecture au
spectromètre à la longueur d'onde de 435nm.
Etablissement de la courbe
d'étalonnage :
Etapes à suivre :
FOn verse des solutions à volumes
différents de la solution étalon NO2-
FOn ajuste par de l'eau distillée
ces volumes dans des fioles de 50 ml et on mélange le contenue
rigoureusement.
FL'échantillon étant
préparé (voir mode opératoire).
FOn remplit jusqu'au trait les cuvettes par le
différentes solution étalons dans une de ces dernière la
concentration inconnu. On place les cuvettes dans
l'appareil.
FAprès avoir effectuer l'essai à
blanc on fixe la longueur d'onde et on mesure pour chaque solution
étalon son absorbance.
FOn trace la courbe d'étalonnage ; a
partir de cette courbe on détermine la concentration inconnue
(de nitrite dans l'eau a analyser) dont on a mesurer son
absence.
FOn effectue les lectures au spectromètre
à la longueur d'onde de 435 nm, et on construit la courbe
d'étalonnage
|
Numéro de fiole
|
T
|
1
|
2
|
3
|
4
|
5
|
|
Solution fille étalon à 0,0023g/l en ml
2.3 ppm
|
0
|
1
|
5
|
10
|
15
|
20
|
|
Eau distillée (ml)
|
50
|
49
|
45
|
40
|
35
|
30
|
|
Réactif de Zambelli (ml)
|
2
|
2
|
2
|
2
|
2
|
2
|
|
Ammoniaque pure en ml
|
2
|
2
|
2
|
2
|
2
|
2
|
|
Correspondance en mg/l de
NO2-
|
0
|
0,046
|
0,23
|
0,46
|
0,69
|
0,92
|
Calcul des concentrations de No2-
après dilution :
Pour calculer les concentrations Ci, on se base sur la
relation suivante :
C*V = Ci * Vi.
Etant :
C : la concentration de la solution
étalon de nitrite est de 2.3 mg/l.
Ci : concentration de la
solution fille (à déterminer).
V : volume de la solution étalon
(selon le tableau).
Vi : volume de la solution
à déterminer, sa concentration est de 50 ml.
CNO2-= 0,0023g/l = 2,3 mg/l
C1 = (C * V) / V1
CT = (0 * 2.3) + (50 * 0) / VT
d'eau distillée
C1 = (10-.3 * 2.3 * 1) + (49*0) /
50*10-3
C1 = 0,046mg/l
C2 = (5*10-3*2,3) + (45*0) /
50*10-3
C2 = 0,23 mg/l.
C3 = (10-.3 * 2.3 * 10) +
(49*0) / 50*10-3
C3 = 0,46 mg/l.
C4 = (10-.3 * 2.3 * 15) + (49*0) /
50*10-3
C4 = 0,69 mg/l
C5 = (10-.3 * 2.3 * 20) + (49*0) /
50*10-3
C5 = 0.92 mg/l
Expression de résultats:
|
Numéro
|
T
|
1
|
2
|
3
|
4
|
5
|
Echantillon
|
|
Concentration
mg/l
|
0
|
0,046
|
0,23
|
0,46
|
0,69
|
0,92
|
CX
|
|
Absence nm
|
0
|
0.033
|
0.062
|
0.146
|
0.219
|
0.995
|
0
|
La courbe d'étalonnage CNO2= f (A) donne
directement la teneur en nitrates exprimée en mg/l d'eau.
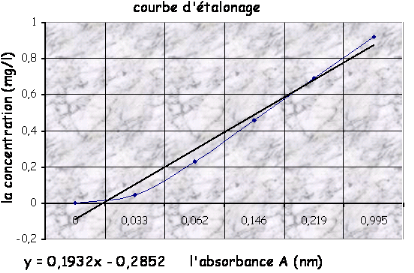
![]()
Réponses :
Préparation de la solution
fille:
La solution étalon mère de
NO2- à 0,23 g/l
On doit amener 1 ml de la solution mère à 100ml
avec de l'eau distillée
C1. V1 = C2
.V2 ð C1 = 0,23 g/l ; V1 =
1ml ; V2= 100ml, C2= ?
C2= =
La
concentration de solution fille étalon = 0,0023g/l
Pour la préparation d'une solution fille, il faut
prendre 1 mi de solution mère (0.23 g/l) et faire dissoudre avec de
l'eau distillée dans une fiole jaugée de 100 ml jusqu'au
repère.
La teneur en azote nitreux:
ORIGINE
Pour la concentration des Nitrites NO2-
MNO2 = 46 g ð 4 g de N
ð x = ( x' . 46 )/14 = 3.28
x g ð x'g
Donc la teneur en azote nitreux est de : 0.2102 * 3.28 =
0.6895 mg/l
ð NO2- = 0.6895
mg/l
D'après le graphe :
On a Abs= 0 donc la Cx = 0 .
Les inconvénients de la présence des
nitrites dans l'eau potable:
Les nitrites peuvent être rencontrés dans les eaux,
mais généralement à des faibles doses.
En ce qui concerne les eaux destinées à la
consommation humaine, une enquête du ministère de la santé
réalisée en France en 1981, à montrer que seulement 1% de
la population reçoit une eau dont la teneur en nitrites est
supérieur à 0.1 mg/l.
Une eau qui renferme des nitrites est à
considérée comme suspecte. Il est important de signaler que les
eaux en contact avec certains terrains et certaines conduites peuvent contenir
des nitrites indépendamment de toute souillure.
On trouve aussi quelques fois des nitrites non liés
à une pollution dans les eaux pauvres en oxygène, leur
présence a été signalée dans les eaux de pluie et
dans les eaux provenant de la fonte des neiges, il sont aussi susceptibles de
se former sous l'action de bactéries et des température
élevées à partir des chloramines crées au cours de
la désinfection par réaction sur l'ammoniaque. Il a
été aussi observé que la teneur en nitrites de l'eau,
stockées à des températures de l'ordre de 40°C
pouvait s'élever probablement sous l'influence d'une action microbienne,
leur emploi comme inhibiteur de corrosion dans les stations de traitement des
eaux peut aussi conduire des erreurs d'interprétation, du point de vue
de la toxicité qui est très significative en raison de leur
pouvoir oxydant, il faut retenir que les nitrites peuvent avoir une action
méthénoglobinisante. Comme cela est indiqué à
propos desnitrites.
Donc on peut dire que la présence des nitrites peut
provoquer l'oxydation du fer que contient l'hémoglobine, cette
dernière se transforme en méthémoglobine et ne peut plus
assurer le transport de l'oxygène vers les organes l'hémoglobine
du sang, transformée en méthémoglobine, du fait de
l'oxydation du fer qu'elle contient par les nitrites, ne peut plus assurer le
transport de l'oxygène.
Conclusion
Les nitrites proviennent soit d'une oxydation incomplète
de l'ammoniaque, la nitrification n'étant pas conduite à son
terme soit d'une réaction des nitrites sous l'influence d'une action
dénitrifiante.
La direction des communautés européennes et la
réglementation Française indiquent comme teneur des nitrites dans
les eaux potables une valeur limite de 0.1 mg/l.
Au cours de la décontamination microbienne de l'eau 0.5
mg/l de NO2 en N détruit presque 0.5 mg/l de chlore, la
présence de nitrites présente des inconvénients pour le
traitement de laine de soie.
DOSAGE DES NITRATE (NO3-)
«METHODE DE BRUCINE »
Introduction :
D'amont en aval, le fleuve produit des nitrites et des nitrates
en consommant la pollution azotée la plus oxydable (Azote organique +
ammonium). Dans des conditions d'oxygénation suffisante, l'ammonium est
oxydé dans le fleuve en nitrites, puis en nitrates par l'action de
bactéries spécialisées (Nitrosomas, Nitrobacter) suivant
les réactions suivantes :
NH4+ + (3/2) O2 ð
NO2- + H2O + 2H+
NO2- + ½ O2
ð NO3-
L'oxydation d'une molécule d'ammonium consomme donc deux
molécules d'oxygène.
L'azote sous forme nitrate est un sel nutritif utilisable par la
majorité des végétaux.
Ces réactions chimiques sont sous la dépendance de
la température et du débit du fleuve. En hiver, la faible
température ralentit l'oxygène dissous : plus d'azote sous
forme oxydable parvient à l'estuaire. En été,
l'échauffement favorise les réaction d'oxydation alors que le
débit est faible : l'azote arrive à l'estuaire
essentiellement sous forme de nitrates moins dilués et la consommation
d'oxygène est à son maximum.
Principal source de nitrates :
Les nitrates sont apportés principalement par
l'alimentation, et par l'eau de boisson. L'essentiel des apports est dû
aux végétaux qui chez l'homme sont à l'origine de 80% des
nitrates ingérés quand l'eau ne représente qu'une petite
proportion (généralement moins de 10 à 15%). Notre
organisme fabrique aussi des nitrates, notamment par le biais des glandes
salivaires, une source loin des d'être négligeable.
Les légumes contiennent de fortes quantités de
nitrates (2000 mg/kg dans la laitue, les épinards, la betterave
davantage dans les navets et la scarole).
Les engrais utilisés pour les grandes cultures sont riches
en matières azotées.
Les excès des nitrates et leur entraînement par les
eaux pluviales sont limités par un épandage des engrais au moment
précis des besoins des plantes, et par l'utilisation de certaines
pratiques culturales destinées à piéger les nitrates
pendant la période d'arrêt de la végétation et de
forte pluviométrie. Avant l'hiver, les végétaux utiles
sont pour leur croissance les nitrates présents dans le sol. En fin
d'hiver, après en fouissement, la décomposition des plantes
libère l'azote qui sera disponible pour la prochaine culture.
Principe :
Afin de déterminer les nitrates dans les eaux, on
utilise la méthode de l'acide sulfocalicylique.
L'acide sulfocalicylique. Réagit sur les nitrates
en donnant un dérivé : acide nitrosulfosalicylique de
couleur jaune.
Réactifs :
Solution de salicylate de sodium 0,05% ;
Nitrate de potassium ;
Ammoniaque diluée au demi ;
Tartre double de sodium et de potassium ;
Hydroxyde de sodium.
Mode Opératoire
On introduit dans une série de capsules de 60ml
successivement.
|
Numéro de capsule
|
T
|
1
|
2
|
3
|
4
|
|
Solution étalon d'azote nitrique à 5
ppm
|
0
|
1
|
2
|
5
|
10
|
|
Eau distillée
|
10
|
9
|
8
|
5
|
0
|
|
Correspondance en (mg/l) d'azote
|
0
|
0,5
|
1
|
2,5
|
5
|
|
Solution de salicylate de sodium
|
1
|
1
|
1
|
1
|
1
|
Pour l'échantillon on prend 10 ml d'eau à
analyser +1ml de solution de salicylate de sodium. On évapore dans une
étuve à 75°-80°c, puis on laisser refroidir, ensuite on
reprend le résidu par 2 ml d'acide sulfurique concentré en ayant
soin de humecter soigneusement. On attend 10mn, puis on ajoute 15ml d'eau
distillée et 15ml de la solution d'hydrocyde de sodium et de tartrate
double de sodium et de potassium.
Enfin on effectue la lecture ou spectromètre à 1=
415nm (spécifique aux Nitrates)
Expression des résultats :
Après avoir effectuer la lecture au spectromètre,
on obtient les résultats suivants
|
Numéro
|
T
|
1
|
2
|
3
|
4
|
Echantillon
|
|
Concentration mg/l
|
0
|
0.5
|
1
|
2.5
|
5
|
CX
|
|
Absorbance nm
|
0
|
0,108
|
0,209
|
0,431
|
0.548
|
0.02
|
Réponses :
La teneur en azote nitrique en (mg/l) est
donné comme suit:
C = Volume de la solution d'azote nitrique * N / 10
N : normalité de la solution d'azote nitrique =
0.005g/l
CT =
C1 =
C2=
C3 = et C4=
Remarque :
L'influence de la coloration du réactif du salicylate de
sodium prouve la différence de volume de l'autre réactif.
(Solution étalon d'azote nitrique) de chacune des 6 capsules ; et
par conséquent les concentrations d'azote Nitrique seront
différentes.
En trace la courbe d'étalonnage A= f(c) a fin de
déterminer la valeur de la concentration de l'eau à analyser en
azote nitrique (mg/l)
D'après la courbe d'étalonnage de
NO3- (nitrates) on peut trouver la valeur de
concentration à partir de l'équation de la droite. Sachant que
abs = 0.02
Da prés la méthode de l'interpolation
polynomiale on a trouvé :
Cx=c0+c1*x^1+c2*x^2+c3*x^3+c4*x^4, tel que:
x=0.02
Cx = 0.0741032
mg/l.
MNO3 = 62g ð 14g de N
ð x = ( Cx * 62)/14
x g ð x' g
x = 0,328 * x'
D'où x représente la teneur en azote nitrique.
La teneur de l'échantillon en azote
nitrique :
CNO3- = Cx *0.328
= 0.074 * 0.328.
CNO3 = 0,024272 mg/l
PHENOMENE D'EUTROPHISATION:
C'est un enrichissement de lacs, de réservoirs, de
cours d'eau et de rivages marins en sels minéraux qui entraîne une
prolifération de plantes aquatique. Eutrophisation vient du grec
eutrophos qui signifie « ! Bien nourrir ! Les écologistes
utilisent ce terme pour d'écrire des habitats et des communautés
relativement productives. En opposition à des habitats
« !Oligotrophes ! » Caractérisés par une
déficience en sels minéraux nutritifs indispensables à la
croissance des végétaux. En 1919, le limatologiste
suédois Einar Nnauman décrit vit les lacs oligotrophes comme
étant généralement profonds, situés dans des
bassins hydrographiques de roches résistantes, ayant des eaux
transparentes et ne pouvant entretenir qu'une vie animale ou
végétale pauvre caractérisée par la
prédominance des poissons salmonidés (saumons,truites et sembles.
Par contraste, les lacs eutrophes ont une faible profondeur et se trouve
souvent dans les baisses terres. Ils reçoivent des eaux
altérées par contacte avec des roches et des sols tendres et
érodés. Ils entretiennent également une vie
végétale microscopique abondante (principalement des algues et
des cayanobactéries formant le phytoplancton). Des roselières
touffues et des lits de plantes submergées se développent par
fois. On y trouve souvent en abondance des poissons d'eau douce tels que les
perches, les carpes, les brèmes, les gardons et les brochets.
De nombreuses études ont montré que ces
caractéristiques étaient principalement déterminées
par la disponibilité biologique en azote et, plus encore, par la
disponibilité en phosphore. Les nitrates (sels d'azote) sont surtout
produits par l'activité des bactéries nitriques du sol.
Très solubles, les nitrates sont aisément lessivés par
les eaux d'infiltration, s'ils ne sont pas absorbés par les plantes .En
revanche, les phosphates (sel de phosphore) sont peu solubles. Les petites
quantités qui s'échappes avec les eaux d'infiltration se trouvent
généralement sous forme de particules. On pensait autre fois que
les lacs gagnaient naturellement en eutrophie avec le temp. Il semble
maintenant évident que les changements récents sont causés
par l'augmentation du sel s minéral provenant des sols, à la
suite des activités humaines telles que le déboisement, le labour
et fertilisation des terres cultivées. Ces types d'eutrophisation
d'origine humaine porte le nom d'eutrophisation anthropique.
L'apport de phosphore dissous dans les lacs et les cours
d'eau est fortement augmenté par les rejets d'eau. Les détergents
à base de poly phosphates contribuent également à cet
apport dans une proportion significative. Avec l'augmentation la
turbidité de l'eau (due aux particules en suspension), la production de
phtoplancton s'accroît ainsi que le taux de décomposition
bactérienne. A la suite de l'augmentation de population
bactérienne, la consommation d'oxygène devient trop importante et
son nouvellement n'est plus assuré par la diffusion dans l'eau de
l'oxygène provenant de l'atmosphère. En conconséconse, le
volume d'eau disponible pour les poissons diminue et l'eau de réservoirs
nécessite des cyanobactéries toxiques peut se traduire par une
coloration rouge de l'eau et l'empoisonnement de nombreux animaux aquatiques.
En fin, l'augmentation de la décomposition bactérienne engendre
un dégagement d'hydrogène sulfureux à odeur putride.
Il existe malheuresement de nombreux exemples de lacs
touchés par l'eutrophisation. Certains des cas les mieux
étudiés concernent la Suède (lac Norviken, lac Trummen),
l'Europe (lac de zurich, lac de constance) et les Etats-Unis (lac Washington).
Dans les cas les plus graves, les lacs perdent leur trenceparence (avec
l'augmentation des algues en suspension )et leur oxygène profond,
tandis que leurs eaux viciées acquièrent un goût et une
odeur déplaisants. L'eutrophisation a pour conséquence, outre les
pblèmes esthétiques, la dégradation des pêcheries,
l'augmentation du coût du traitement de l'eau potable et la compromission
des activités ludiques.
La tendance à l'eutrophisation peut être
inversée par la réduction de la charge en phosphore. Cette
dernière est réalisée soit en détournant les eaux
responsables, soit en effectuant une précision chimique avec de sels de
fer à des endroits critiques tels que les effluents des stations
d'épuration. Parmi les projets réussis , on peu citer ceux du
lac d'Annecy et du lac Nantua, ceux du Wahnbach Talsperre(Allemagne), du lacs
peu profond s est plus long, car ils recyclent le phosphore de manière
beaucoup plus efficace que les lacs profonds. Des méthodes de
simulation de réseaux trophiques de remplacement (« !bio
manipulation ! ») Peuvent être employées pour
traiter les symptômes d'eutrophisation.
L'éffet d'une concentration
élevée de nitrates dans les eaux de consommation sur la
santé de l'individu :
Bien que les nitrates n'aient pas d'effets toxiques
directs ( sauf a des doses élevées de plusieurs dizaines de
grammes ), le fait qu'ils puissent donner naissance a des nitrites conduit a
une toxicité indirecte ; en ce qui concerne la toxicité a
long terme , il n'a jamais été observé de
phénomènes de cancérogenése avec ces deux types de
sels.
Cette toxicité, provoquée par l'absorption
de petites doses de nitrate est en réaclité due aux nitrites
formés par réduction des nitrates sous l'influence d'une action
bactérienne.
Par contre, dans l'estomac, le liquide gastrique,
insuffisamment acide permet la prolifération de bactéries
réductrices de nitrates, ceux ci diffusent dans la circulation
générale et sont alors responsables de la formation de
méthémoglobine qui résulte de l'oxydation
réversible du fer ferreux de l'hémoglobine en fer ferrique.
Elimination des nitrates :
Les procédés biologiques présentent
l'avantage d'éliminer les nitrates alors qu'avec les
procédés physico-chimiques, ceux ci se retrouvent dans les
rejets.
Les méthodes d'élimination des nitrates en
excès sont techniquement au point, mais les prix de revient
élevés en ont jusqu'ici limité le développement. Si
l'osmose inverse, les résines échangeuses d'ions sont
susceptibles d'être utilisées, ce sont surtout les méthodes
de dénitrification biologique qui sont actuellement
considérées avec faveur.
Dans ces méthodes, les nitrates constituent une source
d'oxygéné pour le développement bactérien , la
multiplication des bactéries nécessite alors dans les
procédés hétéro trophiques l'apport
extérieur d'un substrat carboné ou dans les
procédés auto trophiques, le passage sur un support
soufré qui par oxydation libérer l'azote et donne des
sulfates.
DOSOGE DES PHOSPHATES « PO4-3 »
« METHODE DU REACTIFS ULFOMOLY
BDIQUE »
Introduction :
Le chiffre 11% avancé par « prayon-
Rupel »est sous estimé. De plus, l'apport en phosphates dans
les eaux de surface à plusieurs origines et l'importance relative de la
contribution de ces différent tes sous ces varie d'une région
à l'autre. En zone urbanisée, les activités des
ménages peuvent constituer l'apport principal en phosphate. Une moyenne
sur le territoire européen n'a pas beaucoup de sens car le
problème doit être envisagé à l'échelle de
chaque bassin.
L'épuration des eaux ne peut remplacer la
prévention « prayon- Rupel » déclare qu'il
est inutile d'interdire les phosphates dans les détergents, car la
législation européenne rend obligatoire la déphosphatation
des eaux usées dans l'ensemble des zones sensibles. Ace sujet, il est
déplorable que la Belgique ait pris un tel retard dans l'application
de cette directive.
Actuellement, la plupart des filières d'épuration
en service en Belgique ne traitent pas les phosphates. Il existe des solutions
techniques qui permettent de réduire le taux de phosphate des effluents
domestiques (traitement tertiaire), mais elle sont rarement appliquées
Ainsi la Région Bruxelloise n'est équipée que depuis peu
d'une 1ere station d'épuration, en amont de la capitale.
Celle-ci est du point de vue de traitement tertiaire. La station aval (Bxlnord)
qui devrait mettre en oeuvre un tel traitement, ne sera opérationnelle
qu'en 2005. Cette inexistence actuelle de filière de traitement rend
plus importantes encore les mesures de prévention. De toutes
façons, la prévention doit toujours prévaloir, vu le
coût des frais curatifs, à charge de la collectivité. De
plus, en moyenne les lessives sans phosphates ne coûtent pas plus cher,
d'après nos relevés de prix effectués en 2000.
Pour lutter efficacement contre l'eutrophisation
des eaux, il est nécessaire de conjuguer ces deux action :
diminution à la source des rejets domestiques, et traitement des
phosphates au niveau des stations d'épuration. L'expérience du
lac Léman en est la démonstration la plus connue. Il existe
même des exemples où une réduction de la teneur en
phosphates des lessives permet la réduction, voir l'arrêt du
traitement d'épuration tertiaire, ce que permet de réduire les
coût du traitement de l'eau.
Définition :
Le phosphate c'est un élément essentiel à la
vie aquatique les fortes concentration en phosphate rencontrées dans
l'estuaire indiquent un enrichissement d'origine domestique et agricole
provenant du bassin versant, ainsi que l'existence d'apports directs venant des
activités industrielle.
Les phosphates peuvent être d'origine
organique ou minérale, le plus souvent, leur teneur dans les eaux
naturelles résulte de leur utilisation en agriculture, de leur emploi
comme additifs dans les détergents et comme agents de traitement des
eaux de chaudières. Leur présence dans les eaux de certains
puits, à la compagne, indique la proximité de fumiers, de fosses
septiques ou la possibilité d'infiltration d'eaux de ruissellement
agricoles, riches en engrais.
Elles sont considérées comme responsables du
phénomène d'eutrophisation en rivière. Au moment du
développement du plancton végétal printanier, le phosphore
sous forme de phosphates Po4-3 est consommé puis
que comme les nitrates, c'est un sel nutritif. Sa teneur dans l'eau peut alors
de seconde en dessous de la limite de détection des méthodes
d'analyse courantes.
Dans les eaux saumâtres turbides, la teneur en phosphore
est sous l'influence de la nature et de la concentration en particules fines,
en raison des phénomènes d'adsorption. C'est ce qu'on constate
dans l'embouchure de la seine où dans la bouchon vaseux la teneur en
Po4-3 est proportionnelle à la concentration en
matières en suspension (MES).
But :
Le but de cette manipulation est l'acquisition de la
concentration et la teneur en phosphore et en phosphates d'un
échantillon par le tracé de la courbe d'étalonnage
CPO4 = f (A).
Il est nécessaire de filtrer les échantillons d'eau
avant les mesures, car ce dosage peut être troublé par la
présence des MES.
Principe :
En milieu acide et en présence de molybdate
d'ammonium les orthophosphates donnent un complexe phosphomolybdique qui
réduit par l'acide ascorbique développe une coloration bleu,
susceptible d'un dosage colorimétrique. Certaines formes organiques
pouvaient être hydrolyse au cours de l'établissement de la
coloration et donner des athophosphates, le développement de la
coloration est accéléré par un catalyseur,
l'émétique, tartrate double d'autre moine et de potassium.
Réactifs :
Réactif sulfomolybdique ;
Acide ascorbique cristallisé ;
Dihidroçeno phosphate de potassium cristallisé.
Mode opératoire :
Établissement de la courbe
d'étalonnage :
Introduire dans une série de
fioles jaugées de 25 ml :
|
Numéro de fioles
|
T
|
1
|
2
|
3
|
4
|
5
|
|
Solution étalon de P à (1 mg/l) (ml) 1 ppm
|
0
|
1
|
5
|
10
|
15
|
20
|
|
Eau distillée ( ml)
|
20
|
19
|
15
|
10
|
5
|
0
|
|
Correspondance en ( mg/l) de P
|
0
|
0,05
|
0.25
|
0.5
|
0.75
|
1
|
|
Réactif sulfomolybdique en (ml)
|
4
|
4
|
4
|
4
|
4
|
4
|
|
Acide ascorbique en (g)
|
0.1
|
0.1
|
0.1
|
0.1
|
0.1
|
0.1
|
Ensuite on mélange chaque fiole et on les porte à
l'ébullition pendant 1mn ; on laisse refroidir puis on effectue les
lectures.
On effectue la lecture de l'absorption à une longueur
d'onde ë = 6.8nm à l'aide d'un spectromètre (la
température est compris entre 20 et 25°C.)
Présentation de la solution fille à
partir de la solution mère :
La solution mère des ions PO-34 0.5
g/l. Pour avoir une solution fille de 0.01 g/l =10mg/l. on dilue 1/50
fois.
50ml de solution 0.01 gr/l correspond à 1mll de solution
mère 0.5 gr/l 49mll d'eau distillée.
Expression des résultats:
Après avoir effectuer la lecture au spectromètre,
on obtient les résultats suivants
|
Numéro de capsule
|
T
|
1
|
2
|
3
|
4
|
5
|
E
|
|
Absorbance
|
0
|
0,019
|
0,083
|
0.184
|
0.262
|
0.345
|
0.165
|
La teneur en phosphate en (mg/l) est donné
comme suit:
D'après la relation C1V1 =
C2V2 on tire :
C = Volume de la solution de phosphate * N /
20
N : normalité de la solution de phosphate = 1 mg/l
CT = 0/20 * 1 = 0
C1 = 1 / 20 * 1 = 0.05 mg/l
C2= 5 / 20 * 1 = 0.25 mg/l
C3 = 10 /20 * 1 = 0.5 mg/l
C4= 15 / 20 * 1 = 0.75 mg/l
C5= 20 / 20 * 1 = 1 mg/l
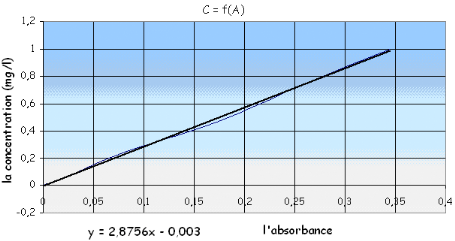
![]() En trace la courbe d'étalonnage
A= f(c) a fin de déterminer la valeur de la concentration de l'eau
à analyser en phosphate (mg/l) En trace la courbe d'étalonnage
A= f(c) a fin de déterminer la valeur de la concentration de l'eau
à analyser en phosphate (mg/l)
3)
D'après la courbe d'étalonnage qu'on a
présentée sous forme de droite on peut déterminer
Cx :
Sachant que l'absorbance A = 0.165 et l'équation de la
droite
Cx = y = 2.8756 x - 0.003 avec :
Y : la concentration
X : l'absorbance
Cx = 2.8756 * 0.165 - 0.003
Cx = 0,471474
mg/l
La teneur en phosphates X :
La masse molaire du phosphate = MPO43- =
94.97g/mole
La masse molaire du phosphore = 30.97g/mole
Un ion gramme de phosphate, contient un atome gramme de
phosphore, alors un cherche combien de mg en PO43-
contient 0.8107 mg/l
94.97g ð 30.97g de P
X = (94.97 * 0,471474) / 30.97
X g ð 0,471474
ð XPO4- =1,445 mg/l
Interprétation :
Le phosphate joue un rôle très
important dans le développement des algues, il est susceptible de
favoriser leurs multiplication dans les réservoirs, les gosses
canalisation et les eaux des lacs, où il contribue à
l'eutrophisation, phénomène auquel le milieu s'enrichit en
matières nutritives d'une manière excessive dons en algues et
plancton, il en résulte une véritable dégradation qui peut
devenir irréversible.
L'origine des phosphates :
Les phosphates font partie des anions facilement fixés par
le sol, leur présence dans les eaux naturelles est liée à
la nature des terrains traversés et à la décomposition de
la matière organique, dans les zones phosphatières, souvent
associés à des fluorures. Dans le cas du traitement des eaux
brutes, les phosphates peuvent perturber l'efficacité de la coagulation
et l'adoucissement.
Dans les eaux de puits, la présence de phosphate peut
avoir pour origine une infiltration en provenance des fosses d'aisance ou de
dépôt du fumier. Les eaux de surface ou de nappes peuvent
être contaminées par les rejets industriels et domestiques ou par
lessivage des terres cultivées referment des engrais phosphatés
ou traité par certains pesticides.
Les phosphates peuvent aussi provenir des traitements de
vaccination des eaux industrielles contre la corrosion et l'entartrage ou des
adjuvants actifs ajoutés aux détergents, ceux-ci participent
à la diminution de la dureté de l'eau.
Les phosphates s'échappent en majeure partie (80%) au
traitement des stations d'épurations biologique classique et de ce fait,
se retrouvent dans les rejets.
Cependant, la diphosphatation biologique par ajout d'une zone
anaérobiènne tête d'un système à boues
activées est en cours de développement. Les traitement
physico-chimique de caprification peuvent éliminer de 80 à 85% de
phosphate suivant le réactif utilisé et le PH. Donc les apports
de phosphore sont d'origine :
Ø Agricole (utilisation d'engrais) ;
Ø Industrielle (détergents) ;
Ø Domestique (un habitant rejette en moyenne 4 g de
phosphate par jour), une moitié due aux détergents, l'autre au
phosphore métabolique.
Ø Conclusion :
L'ion phosphate PO4-3 et l'anion de
l'acide orthopédique H3PO4 acide de force moyenne.
En tant que de triacide il est susceptible de former trois services de sel.
Phosphates neutre Na3
PO4, Ca(PO4)2 de hydrogènophosphates,
Na2HPO4 et ditry
Hogenophosphates , NaH2 PO4
Ca
(HPO4)2 et C
Le réactif molybdique c'est à dire la solution. De
molybdate d'ammonium (NH4)2MbO4 forme avec le
phosphate une solution jeune.
PO4-3 + 3
NH4+ + 12 Mo O4- + 24 H+
= (NH4) H4 [P (Mo2
O7)6]+ 10 H2O
La réduction de cet acide peut entre effectuée sous
l'action de l'acide ascorbique.
D'après nos résultats on remarque que concentration
des faibles par rapport phosphate dans l'eau à analyser est la plus
faible par rapport aux autres échantillons.
Cette valeur est due au faible teneur des est due au faible
teneur des phosphates de notre eau. De plus, a l'état soluble est
assimilable le phosphore est relativement moins disponible que les autres
éléments essentiels comme l'azote et le nitrate à cause de
faibles sources industrielles qui peut provenir.
On effet, au Canada les poly phosphates sont ajoutes à
l'eau potable pour combattre la corrosion des réseaux de distribution.
6°/ un détergent est une préparation se
présentant sous forme de poudre, de liquide ou de pâte dissoute
à des doses convenables dans l'eau, elle constitue un bain de nature
à faciliter le nettoyage, par un moyen mécanique
approprié, des surfaces solides, fibreuses, comme les textiles ou
continues, par exemple : l'épiderme, la vaisselle, qui y sont
plongées.
Néanmoins, les détergents deviendront une
nuisance : contrairement aux savons, ils ne sont ni solubles ni
biodégradable (PO43- est très
mobile, il s'adsorbe facilement sur les particules).
En effet, une fois mélangés à l'eau, ils
restent dans la solution et ne se réduisent pas en molécules
moins complexes et de solubilité supérieur.
OXYDABILITE AU KMNO4 « METHODE A
CHAUD »
Introduction
L'oxydation chimique des matières
organiques et des substances oxydées est effectuée par le
permanganate de potassium à chaud ou à froid, suivant
l'acidité du milieu et la température, l'oxydation est plus ou
moins énergique. Ce test conventionnel permet d'apprécier la
teneur en matière organique en même temps que la présence
d'autres substances réductrices.
Définition
La teneur de permanganate de potassium
(KMnO4) consommée pour l'oxydation des matières
organiques d'une eau pendant un temps donné (4 heures à froid ou
10 minutes à l'ébullition) en milieu acide ou en milieu alcalin.
Le résultat peut être exprimé en mg/l de O2 ou
en mg/l de KMnO4.
Cette notion permet d'estimer la pollution organique globale
d'une eau naturelle et d'apprécier l'efficacité du traitement au
quel elle est soumise.
BUT
Le but de ce TP est de déterminer la
quantité de matières organiques, exprimée en mg de
KMnO4 par litre d'eau, utilisant la méthode à
chaud.
Principe
L'eau est portée à
l'ébullition en présence d'une solution diluée de
permanganate de potassium dont l'excès est dosé après 10
minutes exactement d'ébullition.
Reactifs Utilises
o Solution de permanganate de potassium 0.01 N.
o Solution d'acide oxalique 0.01 N.
o Solution d'acide sulfurique 1.0 N.
Mode Opératoire
Remarque :
o Notre solution de permanganate de potassium est de 0.1N donc
pour travailler avec une solution de permanganate de potassium de 0.01N on fait
dilution de la solution 0.1N jusqu a l'obtention d'une solution 0.01N suivant
la loi de dilution,
N1.V1=
N2.V2
ð N2= N1.V1/
V2 ð
N2=0.1*10/100 ð
N2=0.01N
o Notre acide sulfurique est de 0.1N, 1.84 de densité et
de masse molaire 98.07, et on va travailler avec une solution de 50ml contienne
un volume inconnu d'acide sulfurique de 0.1N, donc on va chercher le volume
nécessaire pour ce la suivant :
N1.V1=N2.V2
.
1000ml à 1840g
100g à 98g d'H2SO4 pure
1840g à X ? ð
X=1803.2g
1litre à 1803.2g d'H2SO4 pure
1mol/l à 98.07g/l
2. à X mol/l ð X=18.38mol/l
98.07g/l à 1mol/l
ð C1.V1=C2.V2
ð V1=C2.V2
/ C1 ð V1=1 * 50 / 18.38 = 2.7ml, donc
on prend 2.7ml d' H2SO4 et on ajoute l'eau
distillé jusqu'à 50ml.
o dans un erlenmeyer de 250 ml, on
introduit :
14. 100 ml d'eau à analyser.
15. 15 ml de la solution d'acide sulfurique 1M.
16. 15 ml de la solution de permanganate de potassium 0.01N.
o le mélange est porté à ébullition
et maintenu pendant 10 minutes ; après refroidissement, on ajoute
15 ml de la solution d'acide oxalique 0.01 N ; la solution est alors
chauffée entre (60 et 70) C° et l'excès d'acide oxalique est
dosé une solution 0.01 de permanganate de potassium.
Expression Des Resultats
o La quantité de matières organiques est
calculée et exprimée par convention en grammes on milligrammes de
KmnO4 utilisés par litre d'eau.
CKMnO4 = [ ( V'KMnO4
+V''KMnO4 ) x N KMnO4 - ( VH2C2O4 x
NH2C2O4 )] x 8
Où :
V' : volume de KmnO4 initial (en
ml) = 10 ml.
V'' : volume de KmnO4
utilisé pour le dosage (en ml) = 3.5 ml.
NKMnO4 = 0,01 N.
VH2C2O4 = 10 ml.
NH2C2O4 = 0,01 N.
Le volume d'eau à analyser = 50ml
Alors :
CKMnO4 = [(10 + 3.5) x 0,01 - (10 x 0,01)] x 8
|
CKMnO4 = 0,28mg de
KMnO4 / l
|
REPONSE AUX QUESTIONS :
L'échantillon d'eau est laissée en
contact avec un volume connu d'une :
Solution de permanganate de potassium titrée. La solution
obtenue est abandonnée dans un flacon pendant 4 heures à la
température ambiante du laboratoire.
On procède ensuite à un
dosage de l'excès de permanganate, par une solution titrante
jusqu'à la décoloration (obtention d'un excès de solution
titrant qu'on va doser par la solution de KMnO4 de départ).
Discussion sur la valeur trouvée
:
Pour l'interprétation des
résultats, il ne faut pas être trop absolu et il sera
nécessaire de les rapprocher de ceux de l'examen
bactériologique ; une teneur élevée en
matières organiques devra toujours faire suspecter une contamination
microbienne.
La directive des communautés
européennes indique pour l'oxydabilité au permanganate ( mesure
faite à chaud et en milieu acide ) de l'eau destinée à la
consommation humaine un niveau guide de 2 mg/l O2 et une
concentration maximale admissible de 5 mg/l O2 .
La vérification du titre de KMnO4
:
Il faut tenir compte de ce que le permanganate
de potassium n'est pas pur, il contient toujours des produits de
réduction en tant qu'impuretés, par exemple MnO2. En
outre, il est facilement décomposé par action des
réducteurs, qui sont entraînés dans l'eau avec la
poussière. Aussi, la concentration d'une solution de KMnO4,
immédiatement après la préparation diminuée.
On en déduit qu'il est impossible de
préparer une solution étalon de permanganate de potassium
à partir d'une prise d'essai précise. Il est indispensable de
déterminer le titre de cette solution en procédant à cette
opération au moins 7 à 10 jours après la
préparation de la solution.
Pour vérifier le titre d'une solution de permanganate de potassium, on
propose différentes substances de base, par exemple H2C2O4. 2H2O,
Na2C2O4, As2O6, le fer métallique, etc. Les substances qui conviennent
le mieux sont Na2C2O4 et H2C2O4. 2H2O. Elles doivent être chimiquement
pures et correspondre exactement à leur formules. L'oxalate de sodium
n'est pas hygroscopique ; il ne contient pas d'eau de cristallisation et
ne se modifie pas au cours de sa conservation. L'acide oxalique est quelque peu
plus difficile à épurer que Na2C2O4, il n'est pas hygroscopique
non plus.
Toutefois, cet acide contient de l'eau de
cristallisation et contrairement à
Na2C2O4, il peut s'effleurir. Les
réactions qui se déroulent lors du titrage de ces corps par le
permanganate de potassium correspondent aux équations :
1) 5 Na2C2O4 + 2
KMnO4 + 8 H2SO4 ð 2 MnSO4
+K2SO4 + 5 Na2SO4 + 8
H2O + 10 CO2
2) 5
H2C2O4 + 2 KMnO4 + 3
H2SO4 ð 2 MnSO4 +
K2SO4 + 8 H2O + 10 CO2
Dans ces deux cas, l'oxydation des ions
C2O42- se produit d'après le
schéma :
C2O42- ð 2
CO2 + 2é
CONCLUSION :
Ce test a en fait un
caractère qualitatif, son interprétation doit être
associée à d'autres caractéristiques chimiques de la
pollution comme l'ammoniaque, les ions ammonium, les nitrites, etc.. La valeur
de ce test qui constitue une des plus anciennes déterminations en
hydrologie a été souvent discutée. Il s'agit en fait, d'un
test sensible, d'une mise en oeuvre commode, mais son intérêt est
limité car il serait plus intéressant de connaître la
teneur des substances en cause plutôt que d'approcher une teneur globale
des matières organiques.
La difficulté analytique
réside dans l'aptitude à l'oxydation des molécules
réductrices qui est en liaison étroite avec les fonctions de leur
constitution. Dans l'eau, les matières organiques ne sont pas seules en
causes et les résultats peuvent être modifiés par d'autres
substances réductrices, telle que les sulfures, les nitrites, le fer
ferreux ... ou subir l'interférence des chlorures surtout si leur teneur
est élevée .
Il a été
estimé que les matières organiques d'origine animale s'oxydaient
plus facilement en milieu alcalin tandis que celles d'origine
végétale l'étaient plutôt en milieu acide.
Cependant, cette interprétation est discutable en raison de la
complexité des phénomènes d'oxydation et de
réduction sur les molécules organiques.
En pratique, les enquêtes
montrent que pour les eaux de surface, l'oxydabilité est plus forte en
milieu acide qu'en milieu alcalin. Il conviendrait donc si l'on ne veut
pratiquer qu'un seul test de l'effectuer plutôt en milieu acide.
Certaines eaux artésiennes, les eaux des régions tourbeuses
chargées d'humus présentent des teneurs en matières
organiques assez élevées tout en étant inoffensives.
DOSAGE DE L'OXYGENE DISSOUS METHODE DE
« WINKLER »
Introduction :
D'autre gaz se dissolvent dans l'eau sans s'ioniser, parmi eux,
l'oxygène, l'azote, le méthane.
L'oxygène est le plus important d'entre eux, quand
à ces effets sur les systèmes d'eau. Si l'eau possède un
indice de Langelier négatif (indice de stabilité supérieur
à 6), on la considère comme agressive et l'on s'attend à
un phénomène de corrosion. Cette corrosion toutefois, est
d'ordinaire due à l'oxygène dissous qui attaque librement la
surface de métal brut, lorsqu'elle est en contact avec de l'eau qui ne
peut former une pellicule protectrice de carbonate de calcium.
Définition :
Dans les eaux naturelles, l'oxygène dissous est un facteur
écologique essentiel car sa présence (milieu aérobie)
permet la respiration des êtres vivants aquatiques.
Bien que toujours présent dans l'eau, l'oxygène
n'en est pas pour autant un élément constitutif. Son origine est
soit l'activité photosynthétique des végétaux
aquatiques, soit la dissolution à partir de l'oxygène
atmosphérique, sa teneur est fonction, en particulier, de la
profondeur : extrêmement faible dans les eaux profondes et parfois
proche de la saturation dans les eaux superficielles. La concentration de
saturation dépend quant à elle notamment de la salinité,
de la pression partielle d'oxygène dans l'atmosphère et de la
température (lois de Henry). Ainsi la concentration de saturation en
oxygène diminue avec la température : dans l'eau pure, de
l'ordre de 11 mg/l à 10 °C, 9 mg/l à 2°C. Des tables
permettent de comparer les concentrations d'oxygènes dissous obtenues
expérimentalement avec la solubilité de l'oxygène à
diverses températures, pression ou degrés de salinité.
L'eau absorbe autant d'oxygène que nécessaire pour
que les pressions partielles d'oxygènes dans le liquide et dans l'air
soient en équilibre.
La solubilité de l'oxygène dans l'eau est en
fonction de la pression atmosphérique (donc de l'altitude), de la
température et de la minéralisation de l'eau : la saturation
en O2 diminue lorsque la température et l'altitude
augmentent.
La concentration en O2 dissous est un paramètre
essentiel dans la maintien de la vie, et donc dans les phénomènes
de dégradations de la matière organique et de la
photosynthèse.
C'est un paramètre utilisé essentiellement pour les
eaux de surface. Au niveau de la mer à 20 °C, la concentration en
oxygène en équilibre avec la pression atmosphérique est de
8.8 mg/l d'O2 à saturation.
Une eau très aérée est
généralement sursaturée en O2 (torrent), alors
qu'une eau chargée en matières organiques dégradables par
des micro-organismes « Sont » est sous-saturée.
En effet, la forte présence de matière organique,
dans un plans d'eau par exemple, permet aux micro-organismes de se
développer tout en consommant de l'oxygène.
L'oxygène dissous est donc un paramètre utile dans
le diagnostic biologique du milieu eau.
Principe de la méthode de
WINKLER :
Ø Selon la méthode de WINKLER, on détermine
la quantité d'oxygène dissous dans l'eau à l'aide de la
réaction de précipitation dans l'eau de l'hydroxyde de
manganèse qui absorbe entièrement l'oxygène qui se trouve
dans l'eau pour aussi former de l'hydroxyde manganique.
Ø Cette substance sous l'action de l'acide chlorhydrique
donne du chlorure manganique qui libère l'iode
« I2 » et l'iodure de potassium KI.
Ø Cette méthode est applicable si l'eau ne contient
pas des matières oxydantes ou réductrices, car elles engendrent
des faux résultats.
Réactifs :
-Solution de NaOH et de KI ;
-Solution d'empois d'amidon ;
-Solution de chlorure de manganèse ;
-Acide chlorhydrique (d = 1,19) ;
-Solution de thioulfate sodium.
Mode opératoire :
Ø On rempli complètement d'eau un flacon de 126 ml
muni d'un bouchon rodé.
Ø On laisse l'eau s'écouler pendant un certain
temps en la faisant arriver au fond du flacon par un tube en verre.
Ø On introduit tout près du fond du flacon avec une
pipette à deux traits de 1ml (1ml du mélange (NaOH + KI) puis de
la même façon 1 ml de MnCl2.
Ø On bouche soigneusement le flacon sans faire entrer des
bulles d'air, en humectant au préalable le bouchon.
Ø On retourne plusieurs fois le flacon et on laisse
déposer le précipité d'hydroxyde de manganèse.
Ø Lorsque la partie supérieure du liquide s'est
complètement clarifiée, on débouche et à l'aide
d'une pipette de 5 ml effilée et bien humectée d'eau.
Ø On fait couler 2,5 ml d'acide chlorhydrique.
Ø On referme le flacon et on agite jusqu'à
dissolution totale du précipité.
Ø On transvase le contenu du flacon dans un erlenmeyer et
on ajoute quelques gouttes de l solution d'amidon.
Ø On titre par la solution de thiosulfate de sodium
(0,01N) jusqu'à décoloration totale.
Expression des résultats:
Vo = volume de la prise d'essai.
XO2 : La teneur de la prise d'essai en
oxygène dissous exprimée en mg/l est donnée par la formule
suivante :
XO2 = (V * n * 8000) / V'
V : le nombre de ml de la solution de thiosulfate de sodium
utilisées = 15.55 ml
XO2 = (17.8 * 0.01 * 8000) / 126
XO2 = =
11.30 mg/l d'eau
INTERPRETATION DES RESULTATS :
La première réaction est de la précipitation
de l'hydroxyde de manganésien :
Mn Cl2 + 2NaOH D
Mn(OH)2î + 2 Na Cl
Le précipité hydroïde de manganèse
Mn (OH)2 absorbe l'oxygéné
présent pour donner l'hydroxyde manganique :
Mn(OH)2 + ½
O2 MnO(OH)2
Cette réaction peut donner aussi du Mn(OH)4 au
lieu de MnO(OH)2 mais dans certaines conditions.
Lors de l'ajout de l'acide HCl, l'hydroxyde manganique donne du
chlorure manganique qui précipite I2
MnO(OH)2 + 2 KI + 4 HCl D I2
î + MnCl2 + 2KCl + 3H2O
2
Na2S2O3 + I2 D 2 NaI +
Na2S4O6
3) la mesure de l'oxygène dissous se réalise soit
par iodométrie ou par électrochimie, ces deux méthodes
étant normalisées :
1. La méthode iodométrique proposée par
WINKLER ;
2. La méthode électrochimique.
La méthode
électrochimique :
Elle est basée sur une mesure ampérométrique
(mesure d'un courant électrique) effectué à l'aide d'une
sonde en utilisant un principe galvanique ou polarographique, constitué
d'une cellule fermée par une membrane perméable à
l'oxygène dissous (en Téflon ou polyéthylène) et
contenant l'électrolyte et deux électrodes métalliques.
les problèmes causés par
l'oxygène dissous dans les chaudières :
L'oxygéné toujours présent dans l'eau n'en
est pas élément constitutif, sa volatilité est en fonction
de la température de la solution, de la pression partielle dans
l'atmosphère et de la salinité.
L'oxygéné dissous conserve sa
propriété oxydante soit par une réaction purement
chimique, d'où son importance dans les phénomènes de
corrosion, sa teneur de l'oxygène dans l'eau dépasse rarement 10
mg/l, elle est fonction de l'origine de l'eau, la variation de la teneur en
oxygéné sont dues a la présence des végétaux
des matières organiques oxydables, des organismes aérobies ainsi
que la perturbation des échanges.
Conclusion :
O2 oxyde les sels manganeux en sels manganiques. Ces
derniers peuvent être titrés par le thiosulfate.
Si on prend un échantillon d'H2O usée et
on veut mesurer la teneur en oxygène dissous après l'avoir
reboucher fermement pendant une durée et temps la concentration
d'oxygène sera nulle, cela est dû à ce que tous les
micro-organismes qui se trouvaient dans cette eau aient consommées tous
l'oxygène.
DOSAGE DE L'ANHYDRIDE CARBONIQUE
Introduction :
Un examen plus attentif de l'indice de Langelier fournit un
enseignement sur la nature et les effets des gaz dissous dans l'eau.
L'anhydride carbonique, par exemple, se dissout pour former l'acide carbonique
qui s'ionise en produisant des ions H+ et
HCO3-.
Les autres gaz ionisés sont : le dioxyde de soufre,
le sulfure d'hydrogène et l'acide cyanhydrique qui forment des acides
faibles lorsqu'ils se dissolvent dans l'eau.
Pour cette raison, l'adjonction d'un acide fort à l'eau
qui contient ces gaz déplacera l'équilibre vers la gauche,
supprimant essentiellement la partie ionisée. De cette façon,
tous les gaz sont dans une forme moléculaire et sont libres de
s'échapper de l'eau sous forme de molécules de gaz. Par exemple,
avec le CO2 :
CO2 +
H2O ïð H2CO3 ïð
H+ + HCO3-
L'addition des ions H+ par addition du
H2SO4 déplace la réaction vers la
gauche.
Lors du contact eau-gaz carbonique celui-ci se dissout :
CO2 gaz ïð CO2 aqueux
Lorsque le CO2 aqueux réagit avec l'eau, il y a
formation d'un acide : l'acide carbonique (H2CO3)
qui lui-même réagit pour former l'ion carbonate
CO32- et l'ion hydrogénocarbonate (bicarbonate)
HCO3- .
L'acide carbonique n'existe qu'aux conditions courantes sous la
forme indiquée qu'en concentration extrêmement faible.
En plus, lors de sa dissolution, le CO2 va plus ou
moins s'hydrater : la formation fournie (H2CO3), est
une simplification d'écriture.
Pour écrire la concentration en CO2 dissous en
utilisera alors la notation [H2CO3]* ou encore
[CO2].
Avec: [H2CO3]* = [O2 ]
aqueux + [H2CO3]
- Le CO2 qui réagit après dissolution
dans l'eau se trouve donc sous deux formes :
· CO2 : hydraté ou non, encore
appelé CO2 libre ;
· CO2 : combiné, encore appelé
CO2 lié ;
- Le CO2 lié peut se présenter sous 2
formes :
· Ion hydrogénocarbonate
HCO3- ;
· Ion carbonate CO32- ;
- Le CO2 total : on définit le
CO2 total par :
CO2T =
[H2CO3]* + [HCO3-] +
[CO32-]
Le CO2 total est aussi appelé carbone
minéral total : CMT en mole ou en milli mole par litre. Cette
grandeur intervient dans l'étude de l'équilibre calco-carbonique
de l'eau.
Les équations d'équilibres chimiques sont :
H2CO3 ïð
HCO3- + H+
HCO3- ïð
CO32- + H+
Ce présent travail a pour objet la description des modes
opératoires des dosages de l'anhydride carbonique total et de
l'anhydride carbonique libre dans les eaux naturelles.
Généralité :
Dans l'anhydride carbonique total des eaux naturelles on peut
distinguer :
· L'anhydride carbonique libre (CO3)
· L'anhydride carbonique des ions bicarbonate
(CO3H-)
· L'anhydride carbonique des ions carbonate
(CO32-).
L'anhydride carbonique libre peut exister tantôt uniquement
sous forme « L'anhydride carbonique équilibrant »,
quantité juste nécessaire pour qu'il n'y ait pas
précipitation des carbonates et qui dépend des divers sels
dissous dans l'eau ; tantôt également en excédent,
dit « L'anhydride carbonique en excès »,
susceptible de dissoudre en particulier du carbonate de calcium.
La fraction d'une eau en anhydride carbonique libre dissous qui
disparaît lors de cette dernière dissolution est dite
« anhydride carbonique agressif pour la calcaire ».
La répartition de l'anhydride carbonique dans les eaux
peut être schématisée de la façon suivante :
CO2 libre
CO2 en excès
CO2 équilibrant
CO2 total
CO2 des bicarbonates
CO2 des ions bicarbonate (CO3 H- )
Et des carbonates
CO2 des ions carbonate (CO3 --)
La teneur d'une eau en anhydride carbonique libre dissous est un
caractère fugace tout comme le sont sa teneur en oxygène dissous
et sa teneur en hydrogène sulfuré.
Principe :
L'anhydride carbonique libre de l'eau est
neutralisé par un léger excès d'une solution d'hydroxyde
de sodium. Cet excès est ensuite déterminé à l'aide
d'une solution titrée d'acide.
Réactifs :
Solution de NaOH (N/40).
Solution alcoolique de phénolphtaleine à (1%).
Solution de HCl (n/10).
Mode opératoire :
Dans une fiole de 200 ml, on introduit une solution de
NaOH (N/40). Si l'eau contient plus de 50 mg de CO2 dans le litre on
double cette quantité, puis on compléte jusqu'au trait de jauge
par l'eau à analyser, en prenant soin d'éviter toute agitation ou
brassage d'air ; on ajoute alors 6-8 gouttes de P.P et on obture le flacon
à l'aide d'un bouchon en caoutchouc bien propre. Puis on retourne la
fiole plusieurs fois afin d'homogénéiser la solution qui doit
prendre une teinte rose.
La solution est ensuite déversée dans un erlenmeyer
de 500 ml ainsi que pour les eaux de lavage de la fiole, on effectue ce
rinçage avec de l'eau distillée fraîchement bouillie, enfin
on titre par la solution d'acide chlorhydrique 0,1N jusqu'à
décoloration.
Soit V le nombre de ml d'HCl utilisés. On fait un essai
à blanc (eau distillée exempte de CO2) en
opérant dans les mêmes conditions. Soit V' le nombre de ml d'HCl
(N/10) utilisés.
Expression des résultats :
A = V'-V = 9.7-1.1 = 8.6 ml
(A/10) mg d'hydrogène correspond aux (A/10)
millimolécules gramme d'hydrogénocarbonate de sodium par
l'anhydride carbonique libre et par suite à (A/10)*44 mg de
CO2 libre ou (A/10)*2 milliéquivalents de CO2
libre.
La prise d'échantillon étant de 190 ml dans le cas
normal, le résultat du dosage en milliéquivalent de
CO2 libre au litre est :
(A/10) * 2 * (1000/190) = (20/19) * A = 1,0526 *
A (méq).
La quantité de CO2en mg/l est donnée par
l'expression :
(1,0526*A)*22 = (1,0526*8.6) *22
= 199,15192 mg/l
ð La
quantité de CO2 = 199,15192 mg de
CO2/l
La présence de CO2 dans l'eau donne une saveur
plus agréable et ne présente aucun inconvénient sur la
santé.
« MATIERE EN SUSPENSION »
«MES»
Définition :
Ce sont des particules solides très fines et
généralement visibles à l'oeil nu, théoriquement,
elles ne sont ni solubilisées, ni à l'état
colloïdale. Elles déterminent la turbidité de l'eau. Elles
limitent la pénétration de la lumière dans l'eau,
diminuent la teneur en oxygène dissous et nuisent au
développement de la vie aquatique.
Ces matières sont en relation avec la
turbidité, leur mesure donne une première indication sur la
teneur en matière colloïdale d'origine minérale ou
organique.
En fait, les limites séparant les trois états sont
indistinctes et seule la normalisation de la méthode d'analyse permet de
faire une distinction précise mais conventionnelle. Les matières
en suspension comportent des matières organiques et des matières
minérales. Toutes les matières en suspension ne sont pas
décantables, en particulier les colloïdes retenus par la
filtration.
La portée de la mesure des matières en suspension
se trouve limitée, le prélèvement opère
déjà une sélection : la mesure donnera
systématiquement un résultat par défaut.
Deux techniques sont actuellement utilisées pour la
détermination des matières en suspension (norme AFNOR
T90-105) ; elles font appel à la séparation par filtration
directe ou centrifugation. On réserve cette dernière
méthode au cas où la durée de la filtration dépasse
une heure environ.
Les causes de la variabilité de la mesure sont nombreuses
(volume de la prise d'essai, teneur en MES de l'échantillon,
séchage à 105 °C jusqu'à poids constant). La
précision reste cependant très acceptable.
Ordres de grandeur de quelques teneurs en MES : Le tableau
(6) près rend compte de quelques concentrations en MES
rencontrées dans différentes eaux résiduaires.
|
Origine des effluents
|
Concentration en mg/l
|
|
Effluents domestiques
|
165 + 25
200+27
|
|
Conserveries
|
salsifis (grattage)
|
5000
|
|
Flageolets verts
|
|
Suifferies
|
2000
|
|
Laiteries
|
400
|
Les enquêtes montrent qu'au niveau d'une habitation les
eaux résiduaires rejetées par un individu contiennent environ 60
g de matières en suspension par jour. Lorsque le réseau de
collecte est de type unitaire, pour tenir compte à la fois des apports
dûs aux eaux de ruissellement et des phénomènes de
rétention dûs aux dépôts dans les canalisations et
à leur remise en suspension, on admet que ces données doivent
être majorées de 20%.
Les matières en suspension (MOS) :
(Matière organique Dissoutes) :
Elles représentent la fraction organique des
matières en suspension. Ces matières disparaissent au cours d'une
combustion et sont mesurées à partir des matières en
suspension (résidu à 105 °C) en les calcinant dans un four
à 525 °C 25 °C pendant deux heures.
Les matières volatiles en suspension représentent
en moyenne 70 % de la teneur en matières en suspension pour des
effluents domestiques.
Ces éléments sont issus des rejets
industriels et urbains et de la dissolution par l'eau de pluie, des
végétaux décomposés présents dans les
couches superficielles des terrains, ces matières organiques solubles
sont attachées fréquemment à l'origine de la coloration de
l'eau ou de mauvais goûts.
Les sels minéraux
dissous :
Ils découlent de la dissolution des roches en contact
avec l'eau au cours de son infiltration, Cette dissolution s'accompagne d'une
transformation de la matière dissoute phénomène
appelé ionisation.
Parmi ces sels minéraux, on trouve les sulfates de
calcium, ou carbonate de calcium.
Ce paramètre englobe tous les éléments
d'origine organique et minérale dont la taille permet leur
rétention sur un filtre de porosité donnée.
La détermination de la MES s'accomplit par filtration ou
par centrifugation.
Ce sont les volumes d'eau usée qui parviennent aux
stations de traitement, ils sont caractérisés par plusieurs
paramètres.
METHODE DE FILTRATION:
Ce procédé s'effectue dans des grands bassins avec
temps de filtration supérieur à une heure.
Domaine d'application :
Ce travail décrit une méthode de dosage des
matières en suspension dans les eaux brutes, les eaux usées et
les effluents, par filtration sur filtre en fibres de verre. La limite
inférieure de dosage est d'environ 2 mg/l. il n'a été
fixé aucune limite supérieure.
Les échantillons d'eau ne sont pas toujours très
stables, c'est à dire que leur teneur en matières en suspension
dépend de la durée de conservation des moyens de transport, du pH
et d'autres circonstances.
Il est recommandé d'interpréter avec
précaution les résultats obtenus à partir
d'échantillons instables.
Les échantillons contenant environ plus de 1000 mg/l de
matières dissoutes peuvent nécessiter un traitement
particulier.
Matières en suspension :
matières éliminées par filtration ou centrifugation dans
des conditions définies.
Matières dissoutes : substances
restantes après filtration d'un échantillon et son
évaporation à siccité dans des conditions
définies.
Principe:
L'eau est filtrée et le poids de matières
retenues par le filtre est déterminé par pesés
différentielles
Mode opératoire :
On pèse le papier filtre soit (M1) mettre de
dispositif de filtration en marche, le volume de la prise d'essai 100 ml. D'eau
brute et on verse le tout sur le papier filtre mettre le papier filtre
dans une étuve à (105 0,5)°C jusqu'à
évaporation total de l'eau , refroidi dans le dessiccateur puis on
pèse la 2 éme fois le papier filtre (M2 )
mettre le papier filtre dans un creuset en platine taré, mettre le
creuset dans un four (25 525)° pendant 2h on pèse
le creuset (M3)
Expression des Résultats:
M1 = 1,0132g
M2 = 1,1219g
M3 = 1.0398g
V = 100ml.
Réponses :
Calcul des MES, MNS par la méthode de
filtration :
Matières en suspension totales MES
:
MES = (M2-M1) 1000/100 =
(1,1219 - 1,0132) 1000/100 = 1.087g/l
MES
= 1,087g/l
Matières minérales en suspension
MNS :
MNS = (M3-M1) 1000/100 =
10 (1.0398 - 1.0132) = 0.8613g/l
MNS = 0.266g/l
Matières organiques en suspension MOS
:
MOS = MES - MNS = 1.087 - 0.266 = 0.821 g/l
MOS = 0.821g/l
CONCLUSION
Sans être chimiste, comprendre c'est de maîtriser, et
cet élément maîtrisé et c'est 80% de la tâche
accomplie. Mais même si ces paramètres sont correctement
appréhendés, il n'en reste pas moins que très souvent nous
ne maîtrisons pas les données de départ :
L'eau disponible dans nos conduites est sujette à bien des
maux causés par la pollution et les produits utilisés pour la
rendre saine, mais aussi par sa nature physico- chimique différente en
fonction des régions, loin de nous l'idée de vouloir une eau
« pure ». Car si cette eau existe sous forme d'eau
distillée, les éléments tels que sels miner aux
nécessaires au développement d'animaux et de
végétaux y sont inexistants. Pour nous, le terme d'eau pure est
une eau non polluée.
Encore une fois, ses qualités chimique. Sont fonction des
sujets à maintenir, car si au sein même d'un petit pays comme la
France nous avons déjà des disparités, à
l'échelle mondiale, nous pensons qu'il est très simple de
comprendre à quel problème nous sommes confrontés.
|
LES COMPOSANTS D'EAU DE BOUSFER
|
|
Conductivité
|
0.767 ms/cm
|
|
pH
|
6.734
|
|
TA, TAC
|
TA=0, TAC=1.82 mg CaCO3/l
|
|
TH
|
290 mg/l de CaCO3
|
|
Chlorure
|
46.15 mg/l, 99.4 mg /l
|
|
NO2-
|
0.689 mg/ l
|
|
NO3-
|
0.024 mg/l
|
|
PO4-3
|
1.445 mg/l
|
|
KMnNO4
|
0.28 mg/l
|
|
O2 dissout
|
11.30 mg /l
|
|
L'anydrique carbonique (CO2)
|
199.151 mg/l
|
Bibliographie
- Traitement des eaux memento technique
- Normes Algériennes de la potabilité de
l'eau
- Procédés unitaires biologiques et traitement
des eaux « Mohand Said OUALI »
- Initiation à la chimie moderne «
André CROS & Gilbert ARRIBET
- Encyclopédie Encarta
- Encyclopédie universalis
- www.wikipedia.org
| 


