DOAGE
DES NITRITE « NO 2-»
METHODE DU REACTIF ZAMBELLI
Introduction :
Suivant l'origine eaux, la teneur en nitrites est assez variable.
La méthode du réactif de peut être appliquée pour
des eaux ayant des teneurs en ions No2- superi eues
à 50 ppb (mg/l) . Il sera nécessaire d'en tenir compte pour
l'interprétation des résultats et de prendre touts les
précaution utiles pour la pureté des réactifs et de la
propreté de la verrerie.
Sous l'action des phénomènes biologiques,
l'équilibre entre l'ammoniac, les nitrites et les nitrates peut
évoluer rapidement. Il convient de procéder au dosage des
nitrites le plus tôt possible après prélèvement en
le conservant à 4 °C.
Définition :
Les nitrites sont considérée comme polluant
très nuisible à la santé de l'être humain et au
animaux (le taux de NO2 devient nocif quand il dépasse 0.5
mg/l). Le taux doit être contrôle régulièrement, un
taux important survient en générale lorsque l'eau est sur
chargée en matières organique, et que les bactéries ne
sont pas suffisantes pour les transformer en nitrates. Cela arrive aussi
parfois lorsque vous rajoutez de nouvelles pierres vivantes.
Principe :
L'Acide sulfamilique en milieu chlorhydrique, en
présence d'ion ammonium et de phénol forme avec les ions un
complexe coloré en jaune dont l'intensité est proportionnelle
à la concentration en nitrites.
Réactifs :
Ammoniaque pure (d=0,928) ;
Réactif de Zambelli ;
HCl ;
Acide sulfamiliquePhénol ;
Chlorure cristallée ;
Eau distillée ;
Solution étalon mère de NO2-
à 0,23.
Mode opératoire :
On prélève 50 ml d'eau à analyser, on
ajoute 2 ml de réactif de Zambelli. On ajuste et on laisse reposer
10 min : on ajoute 2 ml d'ammoniaque, pure, on effectue la lecture au
spectromètre à la longueur d'onde de 435nm.
Etablissement de la courbe
d'étalonnage :
Etapes à suivre :
FOn verse des solutions à volumes
différents de la solution étalon NO2-
FOn ajuste par de l'eau distillée
ces volumes dans des fioles de 50 ml et on mélange le contenue
rigoureusement.
FL'échantillon étant
préparé (voir mode opératoire).
FOn remplit jusqu'au trait les cuvettes par le
différentes solution étalons dans une de ces dernière la
concentration inconnu. On place les cuvettes dans
l'appareil.
FAprès avoir effectuer l'essai à
blanc on fixe la longueur d'onde et on mesure pour chaque solution
étalon son absorbance.
FOn trace la courbe d'étalonnage ; a
partir de cette courbe on détermine la concentration inconnue
(de nitrite dans l'eau a analyser) dont on a mesurer son
absence.
FOn effectue les lectures au spectromètre
à la longueur d'onde de 435 nm, et on construit la courbe
d'étalonnage
|
Numéro de fiole
|
T
|
1
|
2
|
3
|
4
|
5
|
|
Solution fille étalon à 0,0023g/l en ml
2.3 ppm
|
0
|
1
|
5
|
10
|
15
|
20
|
|
Eau distillée (ml)
|
50
|
49
|
45
|
40
|
35
|
30
|
|
Réactif de Zambelli (ml)
|
2
|
2
|
2
|
2
|
2
|
2
|
|
Ammoniaque pure en ml
|
2
|
2
|
2
|
2
|
2
|
2
|
|
Correspondance en mg/l de
NO2-
|
0
|
0,046
|
0,23
|
0,46
|
0,69
|
0,92
|
Calcul des concentrations de No2-
après dilution :
Pour calculer les concentrations Ci, on se base sur la
relation suivante :
C*V = Ci * Vi.
Etant :
C : la concentration de la solution
étalon de nitrite est de 2.3 mg/l.
Ci : concentration de la
solution fille (à déterminer).
V : volume de la solution étalon
(selon le tableau).
Vi : volume de la solution
à déterminer, sa concentration est de 50 ml.
CNO2-= 0,0023g/l = 2,3 mg/l
C1 = (C * V) / V1
CT = (0 * 2.3) + (50 * 0) / VT
d'eau distillée
C1 = (10-.3 * 2.3 * 1) + (49*0) /
50*10-3
C1 = 0,046mg/l
C2 = (5*10-3*2,3) + (45*0) /
50*10-3
C2 = 0,23 mg/l.
C3 = (10-.3 * 2.3 * 10) +
(49*0) / 50*10-3
C3 = 0,46 mg/l.
C4 = (10-.3 * 2.3 * 15) + (49*0) /
50*10-3
C4 = 0,69 mg/l
C5 = (10-.3 * 2.3 * 20) + (49*0) /
50*10-3
C5 = 0.92 mg/l
Expression de résultats:
|
Numéro
|
T
|
1
|
2
|
3
|
4
|
5
|
Echantillon
|
|
Concentration
mg/l
|
0
|
0,046
|
0,23
|
0,46
|
0,69
|
0,92
|
CX
|
|
Absence nm
|
0
|
0.033
|
0.062
|
0.146
|
0.219
|
0.995
|
0
|
La courbe d'étalonnage CNO2= f (A) donne
directement la teneur en nitrates exprimée en mg/l d'eau.
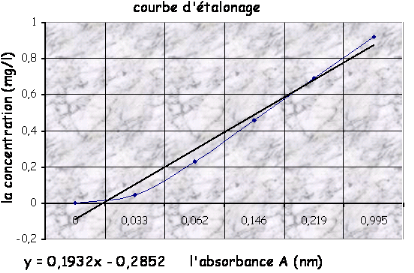
![]()
Réponses :
Préparation de la solution
fille:
La solution étalon mère de
NO2- à 0,23 g/l
On doit amener 1 ml de la solution mère à 100ml
avec de l'eau distillée
C1. V1 = C2
.V2 ð C1 = 0,23 g/l ; V1 =
1ml ; V2= 100ml, C2= ?
C2= =
La
concentration de solution fille étalon = 0,0023g/l
Pour la préparation d'une solution fille, il faut
prendre 1 mi de solution mère (0.23 g/l) et faire dissoudre avec de
l'eau distillée dans une fiole jaugée de 100 ml jusqu'au
repère.
La teneur en azote nitreux:
ORIGINE
Pour la concentration des Nitrites NO2-
MNO2 = 46 g ð 4 g de N
ð x = ( x' . 46 )/14 = 3.28
x g ð x'g
Donc la teneur en azote nitreux est de : 0.2102 * 3.28 =
0.6895 mg/l
ð NO2- = 0.6895
mg/l
D'après le graphe :
On a Abs= 0 donc la Cx = 0 .
Les inconvénients de la présence des
nitrites dans l'eau potable:
Les nitrites peuvent être rencontrés dans les eaux,
mais généralement à des faibles doses.
En ce qui concerne les eaux destinées à la
consommation humaine, une enquête du ministère de la santé
réalisée en France en 1981, à montrer que seulement 1% de
la population reçoit une eau dont la teneur en nitrites est
supérieur à 0.1 mg/l.
Une eau qui renferme des nitrites est à
considérée comme suspecte. Il est important de signaler que les
eaux en contact avec certains terrains et certaines conduites peuvent contenir
des nitrites indépendamment de toute souillure.
On trouve aussi quelques fois des nitrites non liés
à une pollution dans les eaux pauvres en oxygène, leur
présence a été signalée dans les eaux de pluie et
dans les eaux provenant de la fonte des neiges, il sont aussi susceptibles de
se former sous l'action de bactéries et des température
élevées à partir des chloramines crées au cours de
la désinfection par réaction sur l'ammoniaque. Il a
été aussi observé que la teneur en nitrites de l'eau,
stockées à des températures de l'ordre de 40°C
pouvait s'élever probablement sous l'influence d'une action microbienne,
leur emploi comme inhibiteur de corrosion dans les stations de traitement des
eaux peut aussi conduire des erreurs d'interprétation, du point de vue
de la toxicité qui est très significative en raison de leur
pouvoir oxydant, il faut retenir que les nitrites peuvent avoir une action
méthénoglobinisante. Comme cela est indiqué à
propos desnitrites.
Donc on peut dire que la présence des nitrites peut
provoquer l'oxydation du fer que contient l'hémoglobine, cette
dernière se transforme en méthémoglobine et ne peut plus
assurer le transport de l'oxygène vers les organes l'hémoglobine
du sang, transformée en méthémoglobine, du fait de
l'oxydation du fer qu'elle contient par les nitrites, ne peut plus assurer le
transport de l'oxygène.
Conclusion
Les nitrites proviennent soit d'une oxydation incomplète
de l'ammoniaque, la nitrification n'étant pas conduite à son
terme soit d'une réaction des nitrites sous l'influence d'une action
dénitrifiante.
La direction des communautés européennes et la
réglementation Française indiquent comme teneur des nitrites dans
les eaux potables une valeur limite de 0.1 mg/l.
Au cours de la décontamination microbienne de l'eau 0.5
mg/l de NO2 en N détruit presque 0.5 mg/l de chlore, la
présence de nitrites présente des inconvénients pour le
traitement de laine de soie.
| 


