I.1.3. Composition chimique
I.1.3.1. Préparation des solutions à
base de dattes
5 g de dattes sont broyées dans un mortier-pilon.
Après dissolution dans une fiole de 200 ml avec de l'eau chaude, la
solution est refroidie puis ajustée avec de l'eau distillée.
I.1.3.2. Extraction des composés
phénoliques
L'objectif de cette extraction est de libérer les
polyphénols présents dans des structures vacuolaires par rupture
du tissu végétal et par diffusion. Ces derniers sont extraits par
extraction liquide-liquide en utilisant l'eau comme solvant, mais d'autres
solvants peuvent être utilisés tels que le méthanol,
acétonitrile, l'acétone et l'acétate d'éthyle
[@6].
I.1.3.3. Dosage des polyphénols totaux
(réactif de Folin Ciocalteu)
Le dosage des polyphénols a été
effectué au centre de mesure de chimie à l'aide d'un
spectrophotomètre à UV visible à double faisceaux de type
SHIMADZU UV-2401PC, la technique à double faisceaux nous a
aidé à éliminer l'absorbance du blanc et donner
directement la densité optique de l'échantillon. Pour s'assurer
que les résultats sont fiables, le dosage de chaque composé
phénolique a été réalisé en trois essais,
après on a calculé la moyenne des densités optique
mesurées.
Le dosage des polyphénols totaux par la méthode
utilisant le réactif de Folin-Ciocalteu a été
décrite en 1965 par Singleton et Rossi. Depuis, son utilisation s'est
largement répandue pour caractériser les extraits
végétaux d'origines plus diverses [@7].
I.1.3.3.1. Principe
Le réactif de Folin Ciocalteu est un acide de couleur
jaune constitué par un mélange d'acide phosphotungstique
(H3PW12O40) et d'acide phosphomolybdique
(H3PMo12O40). Il est réduit, lors de
l'oxydation des phénols, en un mélange d'oxydes bleus de
tungstène et de molybdène [Ribereau, 1968].
La coloration produite, dont l'absorption maximum à 760
nm, est proportionnelle à la quantité de polyphénols
présents dans les extraits végétaux [Ghazi et
Sahraoui, 2005].
I.1.3.3.2. Mode opératoire
Dans une fiole Jaugée de 20 ml, on introduit :
Ø La solution de dattes (0,2 ml)
Ø Réactif de Folin Ciocalteu (1 ml)
Ø Le bicarbonate (CO3Na2)
à 4,25% (quantité suffisante pour 20 ml).
On prépare dans les mêmes conditions un
témoin avec de l'eau distillée à la place de la solution
de dattes puis on porte au bain-marie à 70°C pendant 20 minutes.
Après refroidissement on détermine la
densité optique à 760 nm par rapport au témoin (voir
figure 13).
L'indice de Folin Ciocalteu est exprimé en degré
ou en gramme d'acide gallique/l, on peut utiliser une gamme-étalon
établie dans les mêmes conditions avec de l'acide gallique (0
à 1 g/l) ou de la D-catéchine [Ghazi et Sahraoui, 2005].
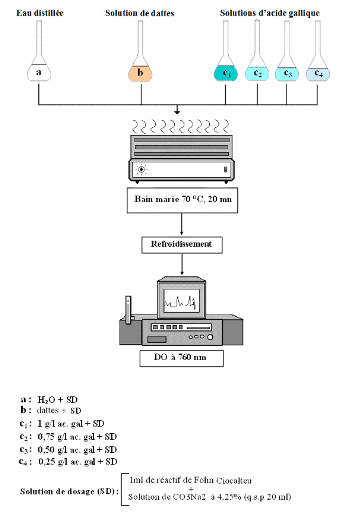
Fig. 13 : Protocole du dosage des polyphénols
totaux dans les dattes
I.1.3.4. Dosage des tanins
condensés
Les tanins sont dosés selon la méthode
colorimétrique de Folin Denis, décrite par Joslyn, 1970.
I.1.3.4.1. Principe
Il est basé sur la réduction de l'acide
phosphomolybdique et tungstique en milieu alcalin, en présence de tanins
pour donner une coloration bleue dont l'intensité est mesurée
à 760 nm sous 1 cm d'épaisseur.
I.1.3.4.2. Mode opératoire
Dans une fiole de 100 ml, on introduit :
Ø 75 ml d'eau distillée ;
Ø 1 ml de la solution de datte ;
Ø 5 ml de réactif de Folin Denis ;
Ø 10 ml de la solution saturée de
CO3Na2
Cette solution saturée est préparée
à partir de 43,75 g de carbonate de sodium dissous dans 100 ml d'eau
chaude (70° à 80°C) après refroidissement la solution
est filtrée puis ajustée à 125 ml. Après agitation
mécanique, la préparation repose pendant 30 minutes, la mesure de
la densité optique est faite à 760 nm.
Une gamme étalon d'acide tannique est
préparée dans les mêmes conditions dont les concentrations
allant de 0 à 0,1 g/l.
Un témoin avec de l'eau distillée à la
place de la solution de datte est réalisé dans les mêmes
conditions (voir figure 14).
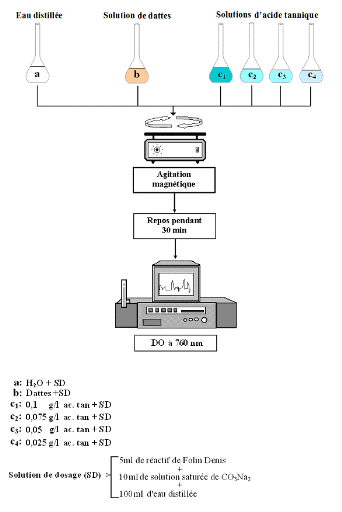
Fig. 14 : Protocole du dosage des tanins
condensés
I.1.3.5. Dosage des anthocyanes
Les anthocyanes sont déterminés par la
méthode basée sur la décoloration par l'acide sulfureux
[Jur, 1967].
I.1.3.5.1. Principe
Le principe est basé sur la décoloration des
solutions d'anthocyanes en utilisant une solution de Bisulfite de Sodium. Le
chercheur Jur (1967) a montré que ce phénomène
était dû à l'existence d'une réaction entre le
cation flavylium et l'hydrogénosulfite HSO3. Cette
réaction est équilibrée et conduit à la formation
d'un produit d'addition incolore et plus ou moins stable selon le pigment.
Cette méthode suppose que les autres composés phénoliques
n'interfèrent pas sur le dosage.
I.1.3.5.2. Mode opératoire
Dans un Erlenmeyer de 50 ml, on introduit : 1 ml de la
solution de dattes ; 1 ml d'éthanol de 0,1 % Hcl et 20 ml d'Hcl
concentrée à 2 %. A partir de cette solution, on place dans un
premier tube à essai 10 ml de la solution et 4 ml d'eau
distillée ; dans un deuxième tube on met 10 ml de la
solution et 4 ml de bisulfite de sodium à 15%.
On procède après une attente de 20 mn, aux
mesures des densités optiques à 520 nm par rapport à l'eau
distillée (voir figure 15).
Les résultats sont exprimés en gramme (g)
d'anthocyanes par millilitre (ml) en se référant à une
courbe d'étalon tracée à partir du tableau 18.
Tableau 18 : Valeur d'étalonnage pour le
dosage des anthocyanes [Anonyme, 1978].
|
Anthocyanes en mg/ml
|
D-O - témoins
|
D-O échantillons
décolorés
|
Différence
|
|
375
187,5
93,5
75
37,5
|
0,450
0,234
0,112
0,086
0,042
|
0,020
0,012
0,003
0,004
0,002
|
0,430
0,222
0,109
0,082
0,040
|
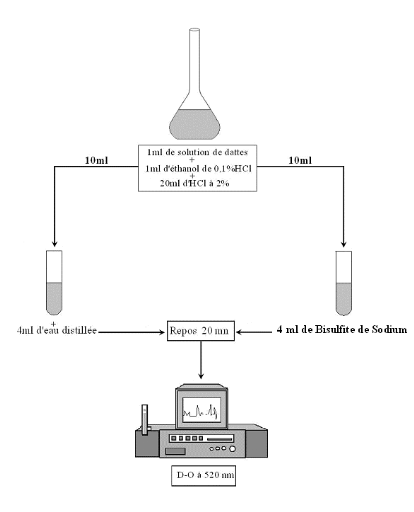
Fig. 15 : Protocole du dosage des
anthocyanes
| 


